题目内容
6.下列分子中,中心原子杂化轨道类型相同,分子的空间构型也相同的是( )| A. | BeCl2、CO2 | B. | H2O、SO2 | C. | SO2、CH4 | D. | NF3、CH2O |
分析 根据价层电子对互斥理论确定中心原子杂化类型,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=$\frac{1}{2}$(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数.根据n值判断杂化类型:一般有如下规律:当n=2,sp杂化;n=3,sp2杂化;n=4,sp3杂化.
解答 解:A.BeCl2中Be价层电子对个数=$\frac{1}{2}$(2+2)=2,采取 sp杂化方式,分子构型为直线型,CO2中C原子价层电子对个数=$\frac{1}{2}$×(4+0)=2,采取sp杂化方式,分子构型为直线型,中心原子的杂化轨道类型相同,空间构型也相同,故A正确;
B.水分子中O原子价层电子对个数=2+$\frac{1}{2}$×(6-2×1)=4,所以采用sp3杂化,分子构型为折线形(V型),SO2中S原子价层电子对个数=$\frac{1}{2}$×(6+0)=3,采取sp2杂化方式,分子构型为平面三角形,二者杂化方式不同,空间构型也不相同,故B错误;
C.SO2中S原子价层电子对个数=$\frac{1}{2}$×(6+0)=3,采取sp2杂化方式,分子构型为平面三角形,CH4中价层电子对个数=4+$\frac{1}{2}$(4-4×1)=4且不含孤电子对,所以C原子采用sp3杂化,分子构型为正四面体形结构,二者杂化方式不同,空间构型也不相同,故C错误;
D.NH3中N原子杂化轨道数为$\frac{1}{2}$×(5+3)=4,采取sp3杂化方式,分子构型为三角锥形,CH2O分子的结构式 ,分子中的C价层电子对个数为3且不含孤电子对,所以采取sp2杂化,立体构型平面三角形,二者杂化方式不同,空间构型也不相同,故D错误;
,分子中的C价层电子对个数为3且不含孤电子对,所以采取sp2杂化,立体构型平面三角形,二者杂化方式不同,空间构型也不相同,故D错误;
故选A.
点评 本题考查原子杂化方式判断,为高频考点,明确价层电子对互斥理论即可解答,难点是孤电子对计算方法,题目难度中等.

| A. | Na2O2在反应中作氧化剂,又作还原剂 | |
| B. | 高铁酸钾在该温度下的溶解度比高铁酸钠的溶解度小 | |
| C. | K2FeO4能消毒杀菌,其还原产物水解生成的Fe(OH)3胶体能吸附水中的悬浮物 | |
| D. | 制取高铁酸钠时,每生成1mol Na2FeO4反应中共有4mol电子转移 |
| A. | Fe3+、H+、SO42-、ClO- | B. | Fe3+、Fe2+、SO42-、NO3- | ||
| C. | Al3+、Na+、SO42-、CO32- | D. | K+、H+、Br-、MnO4- |
| A. | 消耗硫酸亚铁铵的物质的量为n(2-x)mol | |
| B. | 处理废水中Cr2O72- 的物质的量为nxmol | |
| C. | 反应中发生转移的电子数为3n mol | |
| D. | 在FeO•FeyCrxO3中3x=y |
| A. | 配制0.1 mol•L-1 NaCl溶液时,其中一步是将已准确称量的NaCl放入烧杯中并加适量的水搅拌溶解 | |
| B. | 配制1 mol•L-1 NaOH溶液时,将溶解后的NaOH溶液立即注入容量瓶 | |
| C. | 配制0.1 mol•L-1的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释 | |
| D. | 配制1 mol•L-1 Na2CO3溶液500 mL,将Na2CO3放在托盘天平右盘称量 |
| A. | 加热氧化铝 | B. | 加热碳酸钙 | ||
| C. | 电解熔融氯化钠 | D. | 氯化钠与铝粉高温共热 |
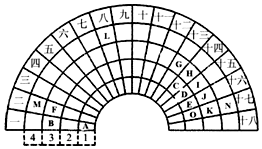 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表,思考扇形元素周期表的填充规律,并回答下列问题:
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表,思考扇形元素周期表的填充规律,并回答下列问题: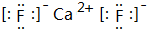 ,用电子式表示CJ2的形成过程:
,用电子式表示CJ2的形成过程: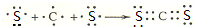 .
.