题目内容
9. 绿矾受热分解后的产物为不含硫元素的固体A、SO2、SO3和H2O.回答下列问题:
绿矾受热分解后的产物为不含硫元素的固体A、SO2、SO3和H2O.回答下列问题:(1)绿矾受热分解后,铁元素的化合价在分解前后是否发生了变化是(填“是”或“否”),其理由是绿矾分解产物中有SO2,硫元素化合价降低,必有元素化合价升高.
(2)在FeO、Fe2O3、Fe3O4三种化合物中,与等质量Fe元素相结合的氧元素的质量比是6:9:8.
(3)将8gFe2O3投入150mL某浓度的稀硫酸中,再投入7g铁粉收集到1.68LH2(标准状况),同时,Fe和Fe2O3均无剩余,为了中和过量的硫酸,且使溶液中铁元素完全沉淀,共消耗4mol/L的NaOH溶液150mL.则原硫酸的物质的量浓度是多少?
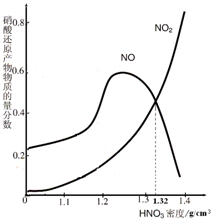
(4)由图示可知,m mol铁与过量的硝酸(ρ=1.32g/cm3)反应,反应放出n L气体(体积在标准状况下测定),其还原产物主要是NO2、NO;此时溶液中Fe元素的存在形式是Fe3+,n 的值是多少?
分析 (1)绿矾( FeSO4•7H2O )中硫的化合价为+6价,反应生成了二氧化硫,化合价降低了,根据氧化还原反应的特征可知,一定有元素的化合价升高,据此判断;(2)由三个化学式可知,铁原子的个数分别为1、2、3,则求得最小公倍数为6,得到如下关系式:6FeO、3Fe2O3、2Fe3O4,即三种化合物中,含有等质量的铁,进行解答;
(3)Fe和Fe2O3均无剩余,而硫酸过量,加入氢氧化钠溶液使溶液中铁元素完全沉淀,最终溶液中的溶质是Na2SO4,由钠离子守恒可知n(NaOH)=2n(Na2SO4),由硫酸根守恒可知n(Na2SO4)=n(H2SO4),再根据c=$\frac{n}{V}$计算;
(4)依据图象可知,密度为1.32g/cm3的硝酸溶液与铁反应生成的还原产物NO2、NO的质量分数大约各占50%,设生成的气体的总的物质的量为nmol,依据得失电子守恒计算生成气体的物质的量.
解答 解:(1)绿矾( FeSO4•7H2O )中硫的化合价为+6价,反应生成了二氧化硫,化合价降低了,根据氧化还原反应的特征可知,一定有元素的化合价升高,所以可以判断有铁元素的化合价在反应过程中升高了,
故答案为:是; 绿矾分解产物中有SO2,硫元素化合价降低,必有元素化合价升高;
(2)根据最小公倍数法求得:6FeO、3Fe2O3、2Fe3O4,即三种化合物中,含有等质量的铁,由题意可知,与等质量铁元素相结合的氧元素的质量比,就是氧原子的个数比,即为6:9:8,故答案为:6:9:8;
(3)Fe和Fe2O3均无剩余,而硫酸过量,加入氢氧化钠溶液使溶液中铁元素完全沉淀,最终溶液中的溶质是Na2SO4,由钠离子守恒可知:n(NaOH)=2n(Na2SO4)=0.15L×4mol/L=0.6mol,故n(Na2SO4)=0.3mol,由硫酸根守恒可知n(H2SO4)=n(Na2SO4)=0.3mol,则c(H2SO4)=$\frac{0.3mol}{0.15L}$=2 mol•L-1,故答案为:2 mol•L-1;
(4)依据图象可知,密度为1.32g/cm3的硝酸溶液与铁反应生成的还原产物NO2、NO的质量分数大约各占50%,硝酸过量生成铁离子,设生成气体物质的量为nmol,则二氧化氮和一氧化氮各占0.5n,依据得失电子守恒规律得:m×3=0.5×n×1+0.5×n×3,解得n=1.5mmol,标况下的体积为:1.5mmol×22.4L/mol=33.6mL,故答案为:NO2、NO;Fe3+;33.6m(L).
点评 本题考查物质的量浓度计算、化学方程式有关计算,清楚发生的反应是关键,注意利用守恒思想进行计算,侧重对解题方法与学生思维能力的考查,难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 苯甲酸共有四个同分异构体(含苯环且包括苯甲酸) | |
| B. | 相同条件下的沸点:乙二醇>乙醇>乙烷>甲烷 | |
| C. | CH3COOCH3在核磁共振氢谱中有两种不同类型的氢原子 | |
| D. | 两种不同的氨基酸在缩聚反应时可生成不少于4种的聚合物 |
(1)铁酸钠(Na 2FeO4)是一种新型水处理剂,它有比高锰酸钾更强的氧化性,在水中反应被还原为Fe 3+.
①铁酸钠中铁元素的化合价为+6.
②铁酸钠用于水处理,除了能消毒杀菌外,还可以像明矾【KAl(SO4)2】一样起到净水作用,请说明明矾的净水原理:Al3++3H2O?Al(OH)3+3H+.(用离子方程式表示)
(2)反应ⅠFe(s)+CO 2 (g)?FeO(s)+CO(g)△H=a kJ?mol -1,平衡常数为K;
反应ⅡCO(g)+$\frac{1}{2}$O 2 (g)=CO 2 (g)△H=b kJ?mol -1 测得在不同温度下,K值如下:
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
②反应Ⅰ中的a大于0(填大于、小于、等于).
③若500℃时进行反应Ⅰ,CO 2 起始浓度为2mol?L -1,CO的平衡浓度为1mol?L -1.
④700℃反应Ⅰ达到平衡,要使得该平衡向右移动,其它条件不变时,可以采取的措施有BC(填序号).
A.缩小反应器体积 B.通入CO 2
C.升高温度到900℃D.使用合适的催化剂
⑤由反应Ⅰ和Ⅱ可求得,反应2Fe(s)+O 2(g)=2FeO(s)的△H=2(a+b)kJ?mol -1.
(3)铁红是一种红色颜料,其成份是Fe2O3.将一定量的铁红溶于160mL 5mol•L-1盐酸中,再加入一定量铁粉恰好完全溶解,收集到气体2.24L(标准状况),经检测,溶液中无Fe3+,则参加反应的铁粉的质量为11.2g.
| A. | 用pH试纸测定水样的pH | B. | 检验硫酸根离子 | ||
| C. | 实验室用高锰酸钾制取氧气 | D. | 从碘水中萃取碘 |
 .
. .
. .
.