题目内容
12.铁元素及其化合物与人类的生产生活息息相关,回答下列问题(1)铁酸钠(Na 2FeO4)是一种新型水处理剂,它有比高锰酸钾更强的氧化性,在水中反应被还原为Fe 3+.
①铁酸钠中铁元素的化合价为+6.
②铁酸钠用于水处理,除了能消毒杀菌外,还可以像明矾【KAl(SO4)2】一样起到净水作用,请说明明矾的净水原理:Al3++3H2O?Al(OH)3+3H+.(用离子方程式表示)
(2)反应ⅠFe(s)+CO 2 (g)?FeO(s)+CO(g)△H=a kJ?mol -1,平衡常数为K;
反应ⅡCO(g)+$\frac{1}{2}$O 2 (g)=CO 2 (g)△H=b kJ?mol -1 测得在不同温度下,K值如下:
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
②反应Ⅰ中的a大于0(填大于、小于、等于).
③若500℃时进行反应Ⅰ,CO 2 起始浓度为2mol?L -1,CO的平衡浓度为1mol?L -1.
④700℃反应Ⅰ达到平衡,要使得该平衡向右移动,其它条件不变时,可以采取的措施有BC(填序号).
A.缩小反应器体积 B.通入CO 2
C.升高温度到900℃D.使用合适的催化剂
⑤由反应Ⅰ和Ⅱ可求得,反应2Fe(s)+O 2(g)=2FeO(s)的△H=2(a+b)kJ?mol -1.
(3)铁红是一种红色颜料,其成份是Fe2O3.将一定量的铁红溶于160mL 5mol•L-1盐酸中,再加入一定量铁粉恰好完全溶解,收集到气体2.24L(标准状况),经检测,溶液中无Fe3+,则参加反应的铁粉的质量为11.2g.
分析 (1)①根据化合价代数和为0计算铁的化合价;
②Al3+水解形成氢氧化铝胶体.
(2)①平衡常数为产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值;
②由表中数据可知,温度越高平衡常数越大,即升高温度平衡向正反应方向进行,温度升高平衡向吸热方向进行;
③令CO平衡浓度为cmol/L,根据三段式求出平衡时,反应混合物气体各组分的平衡浓度,代入①中平衡常数k,列方程计算;
④A、缩小体积,压强增大,反应前后体积不变,改变压强不影响平衡;
B、通入二氧化碳,二氧化碳浓度增大,平衡向其浓度减小的方向移动;
C、升高温度平衡向吸热方向移动;
D、使用催化剂,加快反应速率,不影响平衡移动.
⑤根据盖斯定律求算;
(3)参加反应的铁粉为与铁离子反应及与氢离子反应的两部分之和,根据氢气的体积计算出与盐酸反应的铁的物质的量及HCl的物质的量,再根据氯原子守恒,求出氯化铁的物质的量,进而求出与铁离子反应的铁的物质的量.
解答 解:(1)①令铁酸钠(Na2FeO4)中铁元素的化合价为n,则1×2+n+(-2)×4=0,解得n=+6,
故答案为:+6;
②Al3+水解形成氢氧化铝胶体,氢氧化铝胶体具有吸附性,可以净水,离子方程式为Al3++3H2O?Al(OH)3+3H+,
故答案为:Al3++3H2O?Al(OH)3+3H+;
(2)①平衡常数为产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值,所以平衡常数k=$\frac{C(CO)}{C(C{O}_{2})}$,
故答案为:k=$\frac{C(CO)}{C(C{O}_{2})}$;
②由表中数据可知,温度越高平衡常数越大,即升高温度平衡向正反应方向进行,温度升高平衡向吸热方向进行,所以正反应为吸热反应,即a>0,
故答案为:大于;
③令CO平衡浓度为cmol/L,根据三段式求出平衡时,反应混合物气体各组分的平衡浓度,
Fe(s)+CO2(g)?FeO(s)+CO(g)
开始(mol/L):2 0
变化(mol/L):c c
平衡(mol/L):2-c c
所以$\frac{c}{2-c}$=1,解得c=1,
故答案为:1mol/L;
④A、缩小体积,压强增大,反应前后体积不变,改变压强不影响平衡,故A错误;
B、通入二氧化碳,二氧化碳浓度增大,平衡向其浓度减小的方向移动,即向正反应移动,故B正确;
C、该反应正反应为吸热反应,升高温度平衡向吸热方向移动,即向正反应进行,故C正确;
D、使用催化剂,加快反应速率,不影响平衡移动,故D错误.
故选:BC;
⑤已知:反应ⅠFe(s)+CO2(g)=FeO(s)+CO(g)△H=a kJ?mol-1,
反应ⅡCO(g)+1/2O2(g)=CO2(g)△H=b kJ?mol-1,
所以,反应Ⅰ+反应Ⅱ得:Fe(s)+$\frac{1}{2}$O2(g)=FeO(s)△H=(a+b)kJ?mol-1,
即2Fe(s)+O2(g)=2FeO(s)△H=2(a+b)kJ?mol-1,
故答案为:2(a+b)kJ?mol-1;
(3)氢气的物质的量为 $\frac{2.24L}{22.4L/mol}$=0.1mol,
Fe~~~~2HCl~~~H2,
0.1mol 0.2mol 0.1mol
根据氯原子守恒,所以氯化铁的物质的量为$\frac{1}{3}$×(0.16L×5mol/L-0.2mol)=0.2mol,
Fe~~~2FeCl3
0.1mol 0.2mol
所以参加反应的铁粉的质量为(0.1mol+0.1mol)×56g/mol=11.2g,
故答案为:11.2g.
点评 本题综合性较大,涉及化学平衡、盐类水解、热化学反应方程式等,难度中等,注意(3)中利用关系式计算,简化计算.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 21.6 | B. | 28 | C. | 14 | D. | 56 |
| A. | 、加入氯化铁的目的是加深溶液颜色,放大实验现象 | |
| B. | 、本实验的目的是研究浓度对双氧水分解速率的影响 | |
| C. | 、本实验过程中A、B试管都不明显,可以将那个很不明显的试管放入热水浴中来观察 | |
| D. | 、小明刚把A药品准备好,就有事情出去了,第二天继续这个实验来进行比较 |
| A. | 10-2 | B. | 102 | C. | 2 | D. | 12 |
| A. | 存在于乙酸的分子中 | B. | 存在于乙醇的分子中 | ||
| C. | 存在于乙酸和乙酸乙酯分子中 | D. | 存在于乙醇和乙酸乙酯分子中 |
| A. | 1.00molNaCl中含有6.02×1023个NaCl分子 | |
| B. | 从100mL,1 mol/L的NaCl溶液中取出10 mL,其物质的量浓度是0.1 mol/L | |
| C. | 1.00mol NaCl中,所有Na+的最外层电子总数为8×6.02×1023 | |
| D. | 欲配制1.00L,1.00mol•L-1的NaCl溶液,可将58.5g NaCl溶于1.00L水中 |
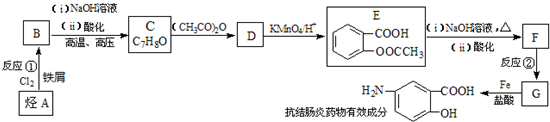
 $→_{盐酸}^{Fe}$
$→_{盐酸}^{Fe}$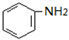 (苯胺易被氧化)
(苯胺易被氧化)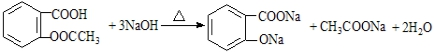 .
.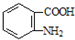 )合成路线中两种中间产物的结构简式(部分反应条件已略去)
)合成路线中两种中间产物的结构简式(部分反应条件已略去)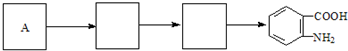
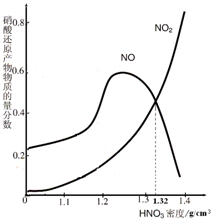 绿矾受热分解后的产物为不含硫元素的固体A、SO2、SO3和H2O.回答下列问题:
绿矾受热分解后的产物为不含硫元素的固体A、SO2、SO3和H2O.回答下列问题: