题目内容
17.NH3可用来合成化肥NH4Cl,若将NH4Cl固体溶解于水,溶液呈酸性,造成这种性质的原因是NH4++H2O?NH3•H2O+H+(用离子方程式表示),该溶液体系中存在多种守恒,请任意写出其中一种守恒(用离子浓度表示):电荷守恒:[NH4+]+[H+]=[Cl-]+[OH-].分析 铵根离子在溶液水解生成NH3•H2O和氢离子,溶液显酸性,溶液中阳离子所带正电荷总浓度等于阴离子所带负电荷总浓度,据此分析.
解答 解:将NH4Cl固体溶解于水,氯化铵电离出铵根离子,铵根离子在溶液水解生成NH3•H2O和氢离子,溶液显酸性,其水解方程式为:NH4++H2O?NH3•H2O+H+,溶液中阳离子所带正电荷总浓度等于阴离子所带负电荷总浓度,即溶液中存在电荷守恒:[NH4+]+[H+]=[Cl-]+[OH-];
故答案为:酸;NH4++H2O?NH3•H2O+H+;电荷守恒:[NH4+]+[H+]=[Cl-]+[OH-].
点评 本题考查了盐的水解、水解方程式的书写、溶液中守恒关系等,题目难度不大,侧重于基础知识的考查,注意相关知识的积累.

练习册系列答案
相关题目
7.常温下,不考虑混合后溶液体积的变化,下列说法错误的是( )
| A. | 0.1mol•L-1CH3COOH溶液加水稀释后,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值增大 | |
| B. | pH=4的CH3COOH溶液和pH=12的NaOH溶液等体积混合后恰好完全反应,则原CH3COOH溶液中CH3COOH的电离度为1% | |
| C. | amol•L-1H2C2O4溶液与2amol•L-1的NaOH溶液等体积混合后,c(C2O42-)>c(HC2O4-)>c(H2C2O4)>c(OH-) | |
| D. | 0.1mol•L-1的下列溶液中:①NH4Al(SO4)2溶液 ②NH4Cl溶液、③CH3COONH4溶液,c(NH4+)的大小顺序为①>②>③ |
12.1998年诺贝尔化学奖授予科恩和波普尔,以表彰他们在理论化学领域作出的重大贡献.他们的实验和理论能共同协力探讨分子体系的性质.下列说法正确的是( )
| A. | 未来化学的研究方向是经验化 | B. | 化学不需要再做实验 | ||
| C. | 化学不再是纯实验学科 | D. | 化学不做实验,就什么都不知道 |
6.7.2gXO中含有0.1mol氧原子,则X的相对原子质量为( )
| A. | 21.6 | B. | 28 | C. | 14 | D. | 56 |
1.乙酸与乙醇的酯化反应中,乙醇的结构简式为 C2H518OH,则反应一段时间后,18O原子存在于( )
| A. | 存在于乙酸的分子中 | B. | 存在于乙醇的分子中 | ||
| C. | 存在于乙酸和乙酸乙酯分子中 | D. | 存在于乙醇和乙酸乙酯分子中 |
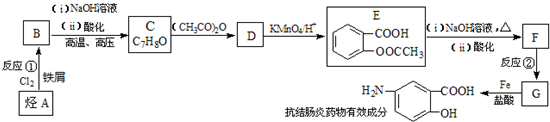
 $→_{盐酸}^{Fe}$
$→_{盐酸}^{Fe}$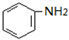 (苯胺易被氧化)
(苯胺易被氧化) .
. )合成路线中两种中间产物的结构简式(部分反应条件已略去)
)合成路线中两种中间产物的结构简式(部分反应条件已略去)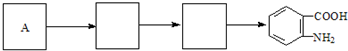
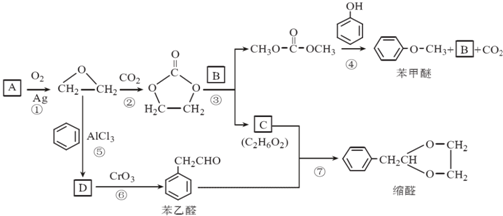
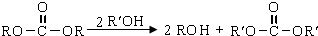
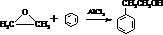 .
.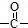 结构的苯乙醛的所有同分异构体的结构简式:
结构的苯乙醛的所有同分异构体的结构简式: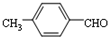 、
、 .
.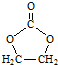 的合成路线,设计一条由2-氯丙烷和必要的无机试剂制备
的合成路线,设计一条由2-氯丙烷和必要的无机试剂制备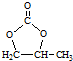 的合成路线(注明必要的反应条件)
的合成路线(注明必要的反应条件)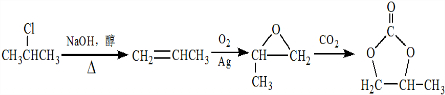 .
. 绿矾受热分解后的产物为不含硫元素的固体A、SO2、SO3和H2O.回答下列问题:
绿矾受热分解后的产物为不含硫元素的固体A、SO2、SO3和H2O.回答下列问题: