题目内容
9.部分化学键的键能数据如表:| 化学键 | H-H | F-F | H-F | H-Cl | H-1 |
| E(kJ/mol) | 436.0 | 157 | 568 | 431.8 | 298.7 |
| A. | 表中最稳定的化学键是H-F | |
| B. | 431.8 kJ/mol>E(H-Br)>298.7 kJ/mol | |
| C. | H2(g)→2H(g)△H=+436.0 kJ/mol | |
| D. | H2(g)+F2(g)→2HF(g)△H=-25kJ/mol |
分析 A.根据键能与化学键稳定性的关系判断;
B.根据同主族元素的递变规律解答;
C.断键需要吸收能量,△H>0表示吸热;
D.根据反应热等于反应物的总键能减生成物的总键能计算反应热.
解答 解:A.键能越大,即形成化学键时放出能量越多,这个化学键越稳定,反之键能越小,化学键越不稳定,H─F的键能最大,受热时最稳定,故A正确;
B.同主族自上而下卤素单质活泼性依次减弱,能量降低,F2>Cl2>Br2>I2,与氢气化合生成氢化物稳定性减弱,所以431.8 kJ/mol>E(H-Br)>298.7 kJ/mol,故B正确;
C.H2(g)→2H(g)表示断开氢原子和氢原子之间的共价键,需消耗能量,△H>0表示吸热,E(H-H)=436.0kJ/mol,所以△H=+436.0 kJ/mol,故C正确;
D.因反应热等于反应物的总键能减生成物的总键能,所以H2(g)+F2(g)→2HF(g)△H=436kJ+157kJ-2×568=-543kJ/mol,故D错误;
故选D.
点评 本题考查了化学键与键能间的关系,注意B选项同主族单质稳定性与能量的关系分析应用,掌握基础是关键,题目较简单.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
18.生活中处处有化学,下列说法中正确的是( )
| A. | 常用的食品包装薄膜的主要成分是聚乙烯或聚氯乙烯塑料 | |
| B. | 食盐可作调味剂、食品防腐剂,还可用于调节体液电解质平衡 | |
| C. | 可利用米汤检验含碘盐的真假 | |
| D. | 利用厨房中的物品可以区别纯净的花生油与菜籽油 |
17.分子式为C9H18O2的有机物Q,在稀硫酸中加热转化为一种与乙酸乙酯互为同分异构体的酸性物质A,同时生成另一种物质B,若不考虑立体异构.则Q的结构最多有( )
| A. | 20种 | B. | 16种 | C. | 10种 | D. | 8种 |
1.用NA表示阿伏伽德罗常数,下列说法正确的是( )
| A. | 19g H3O+ 共用的电子对数为8NA | |
| B. | 将含有NO2与N2O4分子共约NA个的混合气,温度降至标准状况,气体体积约为22.4L | |
| C. | 含10.6g Na2CO3溶液中的离子总数为0.3NA | |
| D. | 0℃、101KPa下,22.4L氦气含质子的数目为2NA |
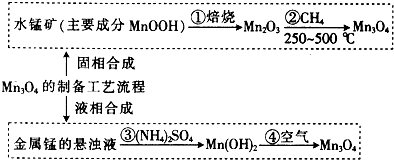
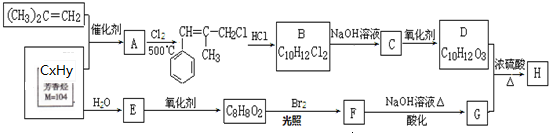
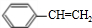
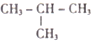 合成(CH3)2C=CH2的路线为:
合成(CH3)2C=CH2的路线为: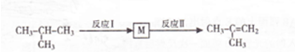 ,反应Ⅰ的条件为光照,写出反应Ⅱ的化学方程式
,反应Ⅰ的条件为光照,写出反应Ⅱ的化学方程式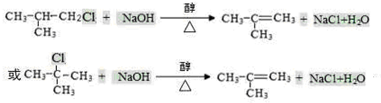
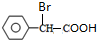 +2NaOH $→_{△}^{水}$
+2NaOH $→_{△}^{水}$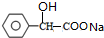 +NaBr+H2O
+NaBr+H2O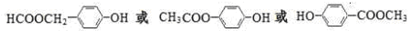 .
.

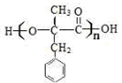
 ;D的核磁共振氢谱共有3组峰.
;D的核磁共振氢谱共有3组峰.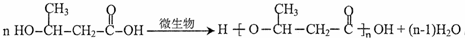 .
. 的合成路线图为
的合成路线图为 .
.