题目内容
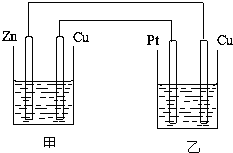 如图所示的装置,甲装置中的电解质溶液为硫酸铜溶液,乙中为稀硫酸,请按以下要求回答问题.
如图所示的装置,甲装置中的电解质溶液为硫酸铜溶液,乙中为稀硫酸,请按以下要求回答问题.(1)在这两个装置中,甲装置是
(2)反应开始一段时间后,甲中锌极质量减少6.5克,此时乙中两极收集到的气体在标准状况下的总体积为
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)甲装置中的电解质溶液为硫酸铜溶液,锌比铜活泼,形成原电池,锌为负极,发生氧化反应,铜为正极,正极上铜离子得电子;乙装置连接原电池为电解池,Cu为阴极,阴极上阳离子得电子;
(2)根据串联电路中转移的电子守恒计算.
(2)根据串联电路中转移的电子守恒计算.
解答:
解:(1)甲装置中的电解质溶液为硫酸铜溶液,锌与溶液中的铜离子发生氧化还原反应,形成原电池,锌为负极,发生氧化反应,铜为正极,正极上铜离子得电子,其正极反应为:Cn2++2e-=Cu;乙装置连接原电池为电解池,Cu为阴极,阴极上阳离子得电子,则阴极上的反应为2H++2e-=H2↑;
故答案为:原电池;Cn2++2e-=Cu;2H++2e-=H2↑;
(2)反应开始一段时间后,甲中锌极质量减少6.5克,则反应的锌的物质的量为
=0.1mol,则转移的电子为0.2mol,所以乙中阴极上的反应为2H++2e-=H2↑,阳极反应为4OH--4e-═2H2O+O2↑,则两极生成的气体总共为0.1mol+0.05mol=0.15mol,其体积为3.36L;
故答案为:3.36L.
故答案为:原电池;Cn2++2e-=Cu;2H++2e-=H2↑;
(2)反应开始一段时间后,甲中锌极质量减少6.5克,则反应的锌的物质的量为
| 6.5g |
| 65g/mol |
故答案为:3.36L.
点评:本题考查了原电池和电解池原理,根据各个电极上电极反应式来分析解答即可,注意电子守恒的应用,题目难度不大.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
在短周期元素中,原子核外有一个未成对电子的元素共有( )
| A、7种 | B、6种 | C、5种 | D、4种 |


 R、R′代表烃基.
R、R′代表烃基. ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:
ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题: 如图所示:
如图所示: 某校化学实验小组同学进行有关NO2气体的系列实验.
某校化学实验小组同学进行有关NO2气体的系列实验.