题目内容
普通玻璃中Na2SiO3:CaSiO3:SiO2=1:1:4(物质的量之比). 以氧化物的形式表示玻璃的组成.若要制备500kg这种玻璃,需要原料各多少千克?共产生标况下的CO2气体多少升?
(相对原子质量 C:12 O:16 Na:23 Ca:40 Si:28)
(相对原子质量 C:12 O:16 Na:23 Ca:40 Si:28)
考点:玻璃的主要化学成分、生产原料及其用途
专题:
分析:硅酸盐改写为氧化物的书写形式,按照活泼金属氧化物、较不活泼金属氧化物、二氧化硅、水顺序书写,注意遵循原子个数守恒定律.
解答:
解:普通玻璃中Na2SiO3:CaSiO3:SiO2=1:1:4(物质的量之比). 以氧化物的形式表示玻璃的组成为:Na2O?CaO?6SiO2,
故答案为:Na2O?CaO?6SiO2.
故答案为:Na2O?CaO?6SiO2.
点评:本题考查了普通玻璃的主要成分及硅酸盐改写成氧化物形式的方法,题目难度不大,改写时应注意各种氧化物的先后顺序,应遵循原子个数守恒的规律.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
在反应3BrF3+5H2O=HBrO3+Br2+9HF+O2中,若有5mol水发生氧化反应,则被还原的BrF3物质的量为( )
| A、2mol | ||
B、
| ||
C、
| ||
| D、5mol |
下列有机物命名正确的是( )
| A、2-乙基戊烷 |
| B、3.3-二甲基丁烷 |
| C、2,2-甲基戊烷 |
| D、间-二甲苯 |
 二甲醚(CH3OCH3)以其优良的性质,被称为21世纪的新型“清洁能源”,在未来可能替代柴油和液化气作为洁净液体燃料使用.工业上以C0和H2为原料生产CH30CH3的新工艺主要发生三个反应:
二甲醚(CH3OCH3)以其优良的性质,被称为21世纪的新型“清洁能源”,在未来可能替代柴油和液化气作为洁净液体燃料使用.工业上以C0和H2为原料生产CH30CH3的新工艺主要发生三个反应: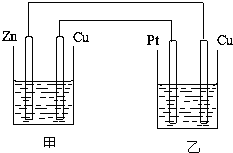 如图所示的装置,甲装置中的电解质溶液为硫酸铜溶液,乙中为稀硫酸,请按以下要求回答问题.
如图所示的装置,甲装置中的电解质溶液为硫酸铜溶液,乙中为稀硫酸,请按以下要求回答问题.
 如图所示的实验装置中,X、Y分别为直流电源的两极.在A、B中充满KOH溶液后倒立于盛有KOH溶液的水槽中,再分别插入多孔铂电极,切断电源开关S1,合闭开关S2,通直流电一段时间后,请回答下列问题:
如图所示的实验装置中,X、Y分别为直流电源的两极.在A、B中充满KOH溶液后倒立于盛有KOH溶液的水槽中,再分别插入多孔铂电极,切断电源开关S1,合闭开关S2,通直流电一段时间后,请回答下列问题: