题目内容
 如图所示:
如图所示:(1)将铜棒和铝棒用导线连接后置于盛稀盐酸的烧杯中,看到的现象是
(2)如果将盐酸换成NaOH溶液,则铝棒做
(3)如果将盐酸换成浓硝酸溶液,则铝棒做
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)铜棒和铝棒与稀盐酸构成原电池,铝棒失电子作负极,铜作正极,正极上氢离子得电子生成氢气;
(2)铜棒和铝棒与氢氧化钠溶液构成原电池,铝棒失电子作负极,铜作正极,正极上水得电子生成氢气;
(3)铜棒和铝棒与浓硝酸构成原电池,Cu失电子作负极,铝作正极,正极上NO3-得电子生成NO2.
(2)铜棒和铝棒与氢氧化钠溶液构成原电池,铝棒失电子作负极,铜作正极,正极上水得电子生成氢气;
(3)铜棒和铝棒与浓硝酸构成原电池,Cu失电子作负极,铝作正极,正极上NO3-得电子生成NO2.
解答:
解:(1)铜棒和铝棒与稀盐酸构成原电池,铝棒失电子作负极,铝逐渐溶解,铜作正极,正极上氢离子得电子生成氢气,所以铜棒上有无色气体生成,铝的电极反应方程式为Al-3e-=Al3+;
故答案为:铜棒上有无色气体生成,铝棒不断溶解;负;Al-3e-=Al3+;
(2)铜棒和铝棒与氢氧化钠溶液构成原电池,铝棒失电子作负极,Al在碱性条件下生成AlO2-,则铝电极的电极反应方程式为:Al-3e-+4OH-=AlO2-+2H2O;
故答案为:负;Al-3e-+4OH-=AlO2-+2H2O;
(3)铜棒和铝棒与浓硝酸构成原电池,铝遇到浓硝酸会钝化,Cu失电子作负极,铝作正极,正极上NO3-得电子生成NO2,所以铝电极的电极反应方程式为:2NO3-+2e-+4H+=2NO2↑+2H2O;
故答案为:正;2NO3-+2e-+4H+=2NO2↑+2H2O.
故答案为:铜棒上有无色气体生成,铝棒不断溶解;负;Al-3e-=Al3+;
(2)铜棒和铝棒与氢氧化钠溶液构成原电池,铝棒失电子作负极,Al在碱性条件下生成AlO2-,则铝电极的电极反应方程式为:Al-3e-+4OH-=AlO2-+2H2O;
故答案为:负;Al-3e-+4OH-=AlO2-+2H2O;
(3)铜棒和铝棒与浓硝酸构成原电池,铝遇到浓硝酸会钝化,Cu失电子作负极,铝作正极,正极上NO3-得电子生成NO2,所以铝电极的电极反应方程式为:2NO3-+2e-+4H+=2NO2↑+2H2O;
故答案为:正;2NO3-+2e-+4H+=2NO2↑+2H2O.
点评:本题考查了原电池原理的应用,注意把握正负极的判断,根据失电子的一极为负极来判断,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
四种仪器中,不能用来加热的是( )
A、 烧杯 |
B、 容量瓶 |
C、 试管 |
D、 烧瓶 |
氯气、溴蒸气分别与氢气反应的热化学方程式如下:
H2(g)+Cl2(g)═2HCl(g)△H1=-Q1kJ/mol
H2(g)+Br2(g)═2HBr(g)△H2=-Q2kJ/mol
已知Q1>Q2>0.
下列说法正确的是( )
H2(g)+Cl2(g)═2HCl(g)△H1=-Q1kJ/mol
H2(g)+Br2(g)═2HBr(g)△H2=-Q2kJ/mol
已知Q1>Q2>0.
下列说法正确的是( )
| A、上述两个反应中反应物的总能量均大于生成物的总能量 |
| B、上述两个反应中反应物的总能量均小于生成物的总能量 |
| C、H2(g)和Cl2(g)反应生成1 mol HCl(g)时放出Q1kJ的热量 |
| D、1molHBr(g)具有的能量大于1molHBr(l)具有的能量 |



 实验室配制480mL 0.1mol?L-1NaOH溶液,回答下列问题
实验室配制480mL 0.1mol?L-1NaOH溶液,回答下列问题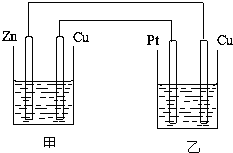 如图所示的装置,甲装置中的电解质溶液为硫酸铜溶液,乙中为稀硫酸,请按以下要求回答问题.
如图所示的装置,甲装置中的电解质溶液为硫酸铜溶液,乙中为稀硫酸,请按以下要求回答问题. Ⅰ.短周期元素R被称为“生命元素”,R元素的最价高氧化物对应的水化物能与其气态氢化物化合生成盐A,写出生成A的化学方程式
Ⅰ.短周期元素R被称为“生命元素”,R元素的最价高氧化物对应的水化物能与其气态氢化物化合生成盐A,写出生成A的化学方程式