题目内容
20.某溶液中可能存在Br-、CO32-、SO32-、Al3+、I-、Mg2+、Na+7种离子中的几种.现取该溶液进行实验,得到如下现象:①向溶液中滴加足量氯水后,溶液变橙色,且有无色气体冒出;
②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色.据此可以推断:
该溶液中肯定不存在的离子是( )
| A. | Al3+、Na+、SON32-、I- | B. | Mg2+、Na+、CO32-、Br- | ||
| C. | Al3+、Mg2+、I-、SO32- | D. | Al3+、CO32-、Br-、SO32- |
分析 ①向溶液中滴加足量氯水后,溶液变橙色,说明溶液中含有Br-,不含I-,且有无色气泡冒出,说明溶液中含离子CO32-;
②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成,说明不含SO32-;
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色,证明溶液中不含I-,所以溶液不变色,不能确定碘离子存在.
解答 解:①向溶液中滴加足量氯水后,溶液变橙色,说明溶液中含有Br-,不含I-,且有无色气泡冒出,说明溶液中含离子CO32-;
②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成,说明不含SO32-;
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色,证明溶液中不含I-,所以溶液不变色;
溶液中含有CO32-,则一定不含有Al3+、Mg2+,因与CO32-反应生成沉淀,
根据溶液呈电中性原则,溶液中一定含有Na+,
所以溶液中一定不存在的离子为I-、Al3+、Mg2+、SO32-,一定含有的离子为CO32-、Br-、Na+,
故选C.
点评 本题考查离子的检验及离子共存问题,题目难度中等,注意把握反应的实验现象,结合离子的性质进行判断.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.在氯化钡溶液中通入SO2,溶液澄清,若将氯化钡溶液分盛两支试管中,一支加入氯水,另一支加烧碱溶液,然后再通入SO2,结果两试管中都有白色沉淀.由此得出下列结论合理的是( )
| A. | 氯化钡有两性 | |
| B. | 两支试管的白色沉淀均为亚硫酸钡 | |
| C. | SO2既有还原性,又是酸性氧化物 | |
| D. | 溶液的碱性增强,增大SO2在水溶液中的溶解度,使SO32-浓度增大 |
12.下列叙述正确的是( )
| A. | 用NaOH溶液、蒸馏水和红色石蕊试纸检验溶液中是否含有NH4+ | |
| B. | 用干燥的pH试纸可测得新制氯水的pH=2 | |
| C. | 有机物A(C4H6O2)能发生加聚反应,可推知A的结构一定是CH2=CH-COOCH3 | |
| D. | 食盐中的碘可以直接用淀粉检验其是否存在 |
9.表是元素周期表的一部分,针对①~⑩种元素,请回答有关问题:
(1)表中化学性质最不活泼的元素,其原子结构示意图为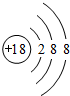 .
.
(2)写出⑤和⑨两种元素的最高价氧化物对应的水化物相互反应的化学方程式Al(OH)3+KOH=KAlO2+2H2O.
(3)用电子式表示④元素与⑦元素形成化合物的过程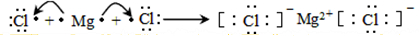 .
.
(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是HClO4(填化学式).
(5)①、⑦两元素形成的化合物电子式是 ,该化合物分子内含有极性键(填“极性”或“非极性”).
,该化合物分子内含有极性键(填“极性”或“非极性”).
(6)可以证明⑦的单质比⑩的单质氧化性强的离子反应方程式为2Br-+Cl2=Br2+2Cl-.
| 周期 主族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
.(2)写出⑤和⑨两种元素的最高价氧化物对应的水化物相互反应的化学方程式Al(OH)3+KOH=KAlO2+2H2O.
(3)用电子式表示④元素与⑦元素形成化合物的过程
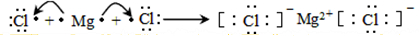 .
.(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是HClO4(填化学式).
(5)①、⑦两元素形成的化合物电子式是
 ,该化合物分子内含有极性键(填“极性”或“非极性”).
,该化合物分子内含有极性键(填“极性”或“非极性”).(6)可以证明⑦的单质比⑩的单质氧化性强的离子反应方程式为2Br-+Cl2=Br2+2Cl-.
 是一种具有菠萝气味的食用香料,是化合物甲与苯氧乙酸
是一种具有菠萝气味的食用香料,是化合物甲与苯氧乙酸 发生酯化反应的产物.
发生酯化反应的产物. $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$ .
. 现有A、B、C、D四种金属片,①把A、B用导线连接后同时浸入稀硫酸中,A上有气泡;②把C、D用导线连接后同时浸入稀硫酸中,D发生还原反应;③把A、C用导线连接后同时浸入稀硫酸中,电子流动方向为A→导线→C.装置如图所示,根据上述情况,回答下列问题:
现有A、B、C、D四种金属片,①把A、B用导线连接后同时浸入稀硫酸中,A上有气泡;②把C、D用导线连接后同时浸入稀硫酸中,D发生还原反应;③把A、C用导线连接后同时浸入稀硫酸中,电子流动方向为A→导线→C.装置如图所示,根据上述情况,回答下列问题: