题目内容
15.在氯化钡溶液中通入SO2,溶液澄清,若将氯化钡溶液分盛两支试管中,一支加入氯水,另一支加烧碱溶液,然后再通入SO2,结果两试管中都有白色沉淀.由此得出下列结论合理的是( )| A. | 氯化钡有两性 | |
| B. | 两支试管的白色沉淀均为亚硫酸钡 | |
| C. | SO2既有还原性,又是酸性氧化物 | |
| D. | 溶液的碱性增强,增大SO2在水溶液中的溶解度,使SO32-浓度增大 |
分析 二氧化硫为酸性氧化物,具有还原性,二氧化硫与氢氧化钠反应生成亚硫酸钠,亚硫酸钠能够与氯化钡反应生成亚硫酸被沉淀,二氧化硫能够与氯水反应生成硫酸,硫酸与氯化钡反应生成硫酸钡沉淀,据此解答.
解答 解:在氯化钡溶液中通入SO2,溶液澄清,若将氯化钡溶液分盛两支试管中,一支加入氯水,二氧化硫能够与氯水反应生成硫酸,硫酸与氯化钡反应生成硫酸钡沉淀,体现二氧化硫的还原性,
另一支加烧碱溶液,然后再通入SO2,二氧化硫与氢氧化钠反应生成亚硫酸钠,亚硫酸钠能够与氯化钡反应生成亚硫酸被沉淀,体现二氧化硫的酸性氧化物的性质,
所以通过实验体现SO2有还原性,是酸性氧化物.
故选:C.
点评 本题考查了物质的性质,熟悉二氧化硫的还原性与酸性氧化物的性质是解题关键,题目难度不大.

练习册系列答案
相关题目
10.我国钨资源矿产丰富.由黑钨矿提取钨发生的反应之一为:3H2+WO3$\frac{\underline{\;高温\;}}{\;}$W+3H2O.其基本反应类型是( )
| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
20.某溶液中可能存在Br-、CO32-、SO32-、Al3+、I-、Mg2+、Na+7种离子中的几种.现取该溶液进行实验,得到如下现象:
①向溶液中滴加足量氯水后,溶液变橙色,且有无色气体冒出;
②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色.据此可以推断:
该溶液中肯定不存在的离子是( )
①向溶液中滴加足量氯水后,溶液变橙色,且有无色气体冒出;
②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色.据此可以推断:
该溶液中肯定不存在的离子是( )
| A. | Al3+、Na+、SON32-、I- | B. | Mg2+、Na+、CO32-、Br- | ||
| C. | Al3+、Mg2+、I-、SO32- | D. | Al3+、CO32-、Br-、SO32- |
7.下列反应既属于氧化还原反应,又是吸热反应的是( )
| A. | 锌粒与稀硫酸的反应 | |
| B. | 灼热的木炭与CO2反应 | |
| C. | 甲烷在氧气中的燃烧反应 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 |
4.下列电子式中错误的是( )
| A. | Na+ | B. | 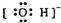 | C. | 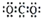 | D. | 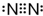 |
 表中所示物质或概念间的从属关系符合右图的是( )
表中所示物质或概念间的从属关系符合右图的是( ) 石油中溶有一种碳氢化合物-金刚烷.金刚烷 是一种环状烃,它的结构高度对称.下图表示金刚烷,图中数字是碳原子编号.碳原子用小黑点表示,氢原子均省略,一条短线表示共用一对电子.
石油中溶有一种碳氢化合物-金刚烷.金刚烷 是一种环状烃,它的结构高度对称.下图表示金刚烷,图中数字是碳原子编号.碳原子用小黑点表示,氢原子均省略,一条短线表示共用一对电子.