题目内容
10.有下列物质的溶液 ①CH3COOH ②HCl ③H2SO4 ④NaHSO4(1)若四种溶液的物质的量浓度相同,其c(H+)的大小比较为③>②=④>①(用序号表示,下同).
(2)若四种溶液的c(H+)相同,其物质的量浓度的大小比较为①>④=②>③.
(3)将6g CH3COOH溶于水制成1L溶液,此溶液的物质的量浓度为0.1 mol•L-1,经测定溶液中 c(CH3COO-)为1.4×10-3 mol/L,此温度下醋酸的电离常数Ka=1.96×10-5,温度升高,Ka将变大(填“变大”、“不变”或“变小”,下同),加入少量CH3COONa后c(H+)变小,Ka不变.
(4)下列方法中,可以使0.10mol•L?1CH3COOH的电离程度增大的是bdf.
a.加入少量0.10mol•L?1的稀盐酸 b.加热CH3COOH溶液
c.加入少量冰醋酸 d.加水稀释至0.010mol•L?1
e.加入少量氯化钠固体 f.加入少量0.10mol•L?1的NaOH溶液.
分析 (1)醋酸是一元弱酸、盐酸是一元强酸、硫酸是二元强酸、硫酸氢钠相当于一元强酸;
(2)醋酸是一元弱酸、盐酸是一元强酸、硫酸是二元强酸、硫酸氢钠相当于一元强酸,据此分析;
(3)n(CH3COOH)=$\frac{6g}{60g/mol}$=0.1mol,根据c=$\frac{n}{V}$计算物质的量浓度;根据k=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$计算其大小并判断升温电离平衡常数的变化,结合外界条件对弱电解质的电离平衡的影响判断离子浓度的变化,电离平衡常数只受温度影响;
(4)醋酸溶液中存在电离平衡CH3COOH?H++CH3COO-,醋酸的电离是吸热反应,加水稀释、加入碱、加热都能促进醋酸的电离.
解答 解:(1)醋酸是一元弱酸、盐酸是一元强酸、硫酸是二元强酸、硫酸氢钠相当于一元强酸,若①CH3COOH ②HCl③H2SO4 ④NaHSO4溶液的物质的量浓度相同,c(H+)的大小顺序为:③>②=④>①,
故答案为:③>②=④>①;
(2)醋酸是一元弱酸、盐酸是一元强酸、硫酸是二元强酸、硫酸氢钠相当于一元强酸,若①CH3COOH ②HCl③H2SO4 ④NaHSO4溶液的c(H+)相同,则其物质的量浓度大小顺序为:①>②═④>③,
故答案为:①>②═④>③;
(3)n(CH3COOH)=$\frac{6g}{60g/mol}$=0.1mol,
c(CH3COOH)=$\frac{0.1mol}{1L}$=0.1mol/L;
c(CH3COO-)=c(H+)=1.4×10-3mol/L,k=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$=$\frac{1.4×1{0}^{-3}×1.4×1{0}^{-3}}{0.1-1.4×1{0}^{-3}}$=1.99×10-5;醋酸电离吸热,升温促进电离,电离平衡常数增大;向醋酸溶液中加入醋酸钠,醋酸根离子浓度增大,醋酸的电离平衡逆向移动,氢离子浓度减小,温度不变电离平衡醋酸不变,
故答案为:0.1mol/L;1.99×10-5;变大;变小;不变.
(4)醋酸的电离是吸热反应,加水稀释、加入碱、加热都能促进醋酸的电离,
a.加入少量0.10mol•L-1的稀盐酸,溶液中氢离子浓度增大,抑制醋酸的电离,则醋酸的电离程度降低,故a错误;
b.醋酸的电离是吸热反应,加热CH3COOH溶液,促进醋酸的电离,则醋酸的电离程度增大,故b正确;
c.加入少量冰醋酸,醋酸的电离平衡向正反应方向移动,但醋酸的电离程度降低,故c错误;
d.加水稀释至0.010mol•L-1,促进醋酸的电离,则醋酸的电离程度增大,故d正确;
e.加入少量氯化钠固体,不影响平衡的移动,则不改变醋酸的电离,故e错误;
f.加入少量0.10mol•L-1的NaOH溶液,氢氧根离子和氢离子反应生成水,氢离子浓度降低,促进醋酸的电离,则醋酸的电离程度增大,故f正确;
故答案为:bdf.
点评 本题综合考查酸碱混合的计算、弱电解质的电离平衡及其影响,侧重于盐类水解和弱电解质电离的考查,题目难度中等,注意熟练掌握弱电解质的电离平衡及其影响因素,试题培养了学生的分析能力及灵活应用能力.

 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案①向溶液中滴加足量氯水后,溶液变橙色,且有无色气体冒出;
②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色.据此可以推断:
该溶液中肯定不存在的离子是( )
| A. | Al3+、Na+、SON32-、I- | B. | Mg2+、Na+、CO32-、Br- | ||
| C. | Al3+、Mg2+、I-、SO32- | D. | Al3+、CO32-、Br-、SO32- |

其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、A13+、Ca2+和Mg2+.
(1)酸浸时,为了提高浸取率可采取的措施有升高反应温度;增大固体颗粒的表面积(答出两点).
(2)H2O2的作用是将滤液I中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:2Cr3++3H2O2+H2O=Cr2O72-+8H+.
(3)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
| 阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | - | - | - |
| 沉淀完全时的pH | 3.7 | 11.1 | 8 | 9(>9溶解) |
(4)钠离子交换树脂的反应原理为Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去的滤液II中的金属阳离子是Ca2+、Mg2+.
(5)写出上述流程中用SO2进行还原时发生反应的化学方程式:3SO2+2Na2CrO4+12H2O=2CrOH(H2O)5SO4↓+Na2SO4+2NaOH.
| A. | Na、Mg、Al的还原性逐渐减弱 | |
| B. | HCl、H2S、PH3、气态氢化物的稳定性逐渐增强 | |
| C. | NaOH、KOH的碱性逐渐增强 | |
| D. | O的原子半径比S的原子半径大 |
| A. | H2O═H++OH- | B. | 2H2O?H3O++OH- | C. | H2O?2H++O2- | D. | H++OH-═H2O |
 (1)已知A和B为第三周期元素,其原子的第一至第四电离能如表1所示:
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如表1所示:表1
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
(2)紫外光的光子所具有的能量约为399kJ•mol-1.根据表2有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因紫外光具有的能量比蛋白质分子中的化学键C-C、C-N、C-S的键能大,紫外光的能量足以使这些键断裂,从而破坏蛋白质分子.
表2
| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |
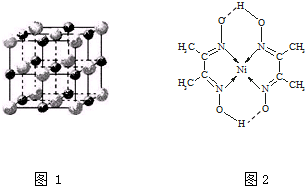
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图1所示),其中3种离子晶体的晶格能数据如表3:
表3
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能(kJ•mol-1) | 786 | 715 | 3401 |
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和CrO2中,适合作录音带磁粉
原料的是CrO2.
(5)某配合物的分子结构如图2所示,其分子内不含有AC(填序号).
A.离子键 B.极性键C.金属键 D.配位键E.氢键 F.非极性键
(6)温室效应主要由CO2引起,科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中CO2.若有1mol CH4生成,则有6molσ键和2molπ键断裂.
| A. | 核电荷数 | B. | 最外层电子数 | ||
| C. | 核内质子数和中子数 | D. | 相对原子质量的大小 |