题目内容
1.关于有机化学实验说法正确的是( )| A. | 石油的分馏和煤的干馏都属于物理变化 | |
| B. | 通过对95%的酒精直接蒸馏获得无水酒精 | |
| C. | 在石油的分馏、实验室制乙烯以及制备硝基苯的三个实验中,温度计水银球的位置分别位于蒸馏烧瓶支管口、反应液液面以下、水浴中 | |
| D. | 用C8H18萃取溴水中的溴,可观察到溶液分层,下层为橙红色,上层接近无色 |
分析 A.煤的干馏属于化学变化;
B.酒精与水易形成共沸混合物;
C.石油的分馏、实验室制乙烯以及制备硝基苯的三个实验中,温度计分别用于测定馏分、反应液以及水的温度;
D.己烷的密度比水小,在溶液上层.
解答 解:A.煤的干馏属于复杂的物理、化学变化,故A错误;
B.酒精与水易形成共沸混合物,应加CaO后蒸馏,故B错误;
C.石油的分馏、实验室制乙烯以及制备硝基苯的三个实验中,温度计分别用于测定馏分、反应液以及水的温度,则温度计水银球的位置分别位于蒸馏烧瓶支管口、反应液液面以下、水浴中,故C正确;
D.己烷的密度比水小,在溶液上层,可观察到上层为橙红色,故D错误.
故选C.
点评 本题考查化学实验方案的评价,涉及化学实验基本操作方面的知识,涉及了除杂、加入试剂顺序、气体的检验方法等知识,侧重实验基本操作和实验原理的考查,本题难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.下列每组中各有三对物质,它们都能用分液漏斗分离的是( )
| A. | 乙酸乙酯和水,酒精和水,植物油和水 | |
| B. | 四氯化碳和水,溴苯和水,硝基苯和水 | |
| C. | 甘油和水,乙酸和水,乙酸和乙醇 | |
| D. | 汽油和水,苯和甲苯,己烷和水 |
6.直接排放含SO2,的烟气会形成胶雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:SO2+H2O?H2SO3、2H2SO3+O2=2H2SO4.
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是2OH-+SO2=SO32-+H2O.
(3)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
①上表判断NaHSO3溶液显酸性,用化学平衡原理解释:HSO3-存在HSO3-?H++SO32-和HSO3-+H2O?H2SO3+OH-,HSO3-的电离程度大于水解程度.
②当吸收液呈中性时,溶液中离子浓度关系正确的是ab
a.c(Na+)═2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H +)═c(OH-)
c.c(Na+)+c(H +)═c(SO32-)+c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,送至电解槽再生.再生示意图如下:

①HSO3-在阳极放电的电极反应式是HSO3-+H2O-2e-=SO42-+3H+.
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用.简述再生原理:氢离子在阴极得电子生成氢气,溶液中氢离子浓度降低,促使HSO3-电离生成SO32-,且钠离子进入阴极室,吸收液就可以再生.
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:SO2+H2O?H2SO3、2H2SO3+O2=2H2SO4.
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是2OH-+SO2=SO32-+H2O.
(3)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
②当吸收液呈中性时,溶液中离子浓度关系正确的是ab
a.c(Na+)═2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H +)═c(OH-)
c.c(Na+)+c(H +)═c(SO32-)+c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,送至电解槽再生.再生示意图如下:

①HSO3-在阳极放电的电极反应式是HSO3-+H2O-2e-=SO42-+3H+.
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用.简述再生原理:氢离子在阴极得电子生成氢气,溶液中氢离子浓度降低,促使HSO3-电离生成SO32-,且钠离子进入阴极室,吸收液就可以再生.
10.尿素燃料电池既能去除城市废水中的尿素,又能发电.尿素燃料电池结构如图所示,甲电极上发生如下反应:CO(NH2)2+H2O-6e→CO2+N2+6H+,则( )
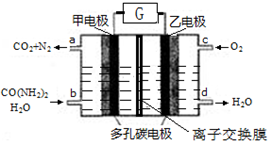

| A. | 甲电极是阴极 | B. | 电解质溶液可以是KOH溶液 | ||
| C. | H+从甲电极附近向乙电极附近迁移 | D. | 每2molO2理论上可净化1molCO(NH2)2 |
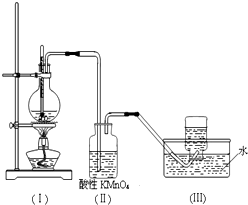 如图所示,在实验室里,通常利用浓硫酸与乙醇混合加热制乙烯,加热一段时间后观察到烧瓶中溶液变黑,装置(Ⅱ)中经硫酸酸化的高锰酸钾溶液褪色.
如图所示,在实验室里,通常利用浓硫酸与乙醇混合加热制乙烯,加热一段时间后观察到烧瓶中溶液变黑,装置(Ⅱ)中经硫酸酸化的高锰酸钾溶液褪色. 科研人员对某岛上山泉水进行分析化验,结果显示山泉水属于硬水.
科研人员对某岛上山泉水进行分析化验,结果显示山泉水属于硬水.