题目内容
15.某未知溶液(只含一种溶质)中加入醋酸钠固体后,测得溶液中c(CH3COO-):c(Na+)=1:1.则原未知溶液一定不是( )| A. | 强酸溶液 | B. | 弱酸性溶液 | C. | 弱碱性溶液 | D. | 强碱溶液 |
分析 某未知溶液(只含一种溶质)中加入醋酸钠固体后,测得溶液中c(CH3COO-):c(Na+)=1:1,可以看做是醋酸钠固体溶解后得到溶液中醋酸根离子水解溶液显碱性,醋酸根离子减小,加入某种试剂满足溶液中c(CH3COO-):c(Na+)=1:1;
解答 解:醋酸钠固体溶解后得到溶液中醋酸根离子水解溶液显碱性,醋酸根离子减小,CH3COO-+H2O?CH3COOH+OH-,满足溶液中c(CH3COO-):c(Na+)=1:1,平衡逆向进行,
A.强酸性溶液会促进水解平衡正向进行,不能满足溶液中c(CH3COO-):c(Na+)=1:1,故A符合;
B.弱酸性溶液如加入少量醋酸会增加溶液中醋酸根离子浓度,可以满足溶液中c(CH3COO-):c(Na+)=1:1,故B不符合;
C.弱碱性溶液如加入弱碱抑制醋酸根离子水解,可以满足溶液中c(CH3COO-):c(Na+)=1:1,故C不符合;
D.强碱溶液如加入KOH溶液抑制醋酸根离子水解,可以满足满足溶液中c(CH3COO-):c(Na+)=1:1,故D不符合;
故选A.
点评 本题考查了盐类水解原理、水解平衡影响因素的分析判断等知识点,掌握基础是解题关键,题目难度中等.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
5.等质量的下列物质燃烧,消耗氧气量最多的是( )
| A. | CH4 | B. | C2H6 | C. | C3H6 | D. | C3H8 |
6.直接排放含SO2,的烟气会形成胶雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:SO2+H2O?H2SO3、2H2SO3+O2=2H2SO4.
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是2OH-+SO2=SO32-+H2O.
(3)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
①上表判断NaHSO3溶液显酸性,用化学平衡原理解释:HSO3-存在HSO3-?H++SO32-和HSO3-+H2O?H2SO3+OH-,HSO3-的电离程度大于水解程度.
②当吸收液呈中性时,溶液中离子浓度关系正确的是ab
a.c(Na+)═2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H +)═c(OH-)
c.c(Na+)+c(H +)═c(SO32-)+c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,送至电解槽再生.再生示意图如下:

①HSO3-在阳极放电的电极反应式是HSO3-+H2O-2e-=SO42-+3H+.
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用.简述再生原理:氢离子在阴极得电子生成氢气,溶液中氢离子浓度降低,促使HSO3-电离生成SO32-,且钠离子进入阴极室,吸收液就可以再生.
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:SO2+H2O?H2SO3、2H2SO3+O2=2H2SO4.
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是2OH-+SO2=SO32-+H2O.
(3)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
②当吸收液呈中性时,溶液中离子浓度关系正确的是ab
a.c(Na+)═2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H +)═c(OH-)
c.c(Na+)+c(H +)═c(SO32-)+c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,送至电解槽再生.再生示意图如下:

①HSO3-在阳极放电的电极反应式是HSO3-+H2O-2e-=SO42-+3H+.
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用.简述再生原理:氢离子在阴极得电子生成氢气,溶液中氢离子浓度降低,促使HSO3-电离生成SO32-,且钠离子进入阴极室,吸收液就可以再生.
3.1,2-二氯乙烯可以形成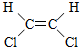 与
与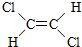 两种不同的空间异构体,下列物质中,能形成类似上述两种空间异构体的是( )
两种不同的空间异构体,下列物质中,能形成类似上述两种空间异构体的是( )
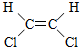 与
与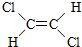 两种不同的空间异构体,下列物质中,能形成类似上述两种空间异构体的是( )
两种不同的空间异构体,下列物质中,能形成类似上述两种空间异构体的是( )| A. | 1,1-二氯乙烯 | B. | 丙烯 | C. | 2-丁烯 | D. | 1-丁烯 |
10.尿素燃料电池既能去除城市废水中的尿素,又能发电.尿素燃料电池结构如图所示,甲电极上发生如下反应:CO(NH2)2+H2O-6e→CO2+N2+6H+,则( )
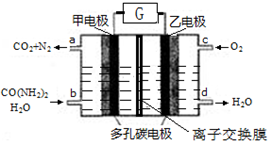

| A. | 甲电极是阴极 | B. | 电解质溶液可以是KOH溶液 | ||
| C. | H+从甲电极附近向乙电极附近迁移 | D. | 每2molO2理论上可净化1molCO(NH2)2 |
7.已知某溶液中含有碳酸钠、硫酸钠、氢氧化钠、氯化钠四种溶质,欲将该溶液中四种溶质的阴离子逐一检验出来,所加试剂先后顺序合理的是( )
| A. | HNO3、Ba(NO3)2、NH4NO3、AgNO3 | B. | HNO3、NH4NO3、Ba(NO3)2、AgNO3 | ||
| C. | NH4NO3、HNO3、Ba(NO3)2、AgNO3 | D. | NH4NO3、HNO3、AgNO3、Ba(NO3)2 |
4.化学与生活、社会发展息息相关,下列有关说法正确的是( )
| A. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 | |
| B. | “丹砂(HgS)烧之成水银,积变又还成了丹砂”,该过程发生了分解、化合、氧化还原反应 | |
| C. | 干燥剂硅胶和硅橡胶的主要化学成分都是二氧化硅 | |
| D. | 铜制品在潮湿的空气中生锈,其主要原因是发生了析氢腐蚀 |
5.CPAE是蜂胶的主要活性成分,也可由咖啡酸合成

下列说法不正确的是( )

下列说法不正确的是( )
| A. | 咖啡酸分子中所有原子不可能处在同一个平面上 | |
| B. | 可用金属Na检测上述反应是否残留苯乙醇 | |
| C. | 1mol 苯乙醇在O2中完全燃烧,需消耗10molO2 | |
| D. | 1mol CPAE与足量的NaOH溶液反应,最多消耗3molNaOH |