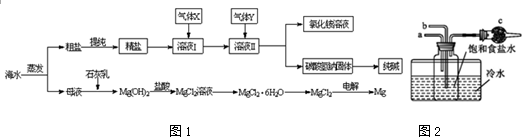
题目内容
下列有关说法正确的是
A.加入硫酸铜可使锌与稀硫酸的反应速率加快,说明Cu2+具有催化作用
B.向某溶液中滴加硝酸酸化的BaCl2溶液产生白色沉淀,则该溶液中含有SO2-4
C.在电解精炼铜过程中,阳极质量的减少多于阴极质量的增加
D.298 K时,2H2S(g)+SO2(g)=3S(s)+2H2O(l)能自发进行,则其ΔH<0
练习册系列答案
相关题目
7.一定条件下,用甲烷可以消除氮的氧化物(NOx)的污染.已知:
①CH4(g)+4NO2 (g)═4NO(g)+CO2 (g)+2H2 O(g)△H1=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2 (g)+CO2 (g)+2H2 O(g)△H2=-1160kJ•mol-1
下列选项不正确的是( )
①CH4(g)+4NO2 (g)═4NO(g)+CO2 (g)+2H2 O(g)△H1=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2 (g)+CO2 (g)+2H2 O(g)△H2=-1160kJ•mol-1
下列选项不正确的是( )
| A. | CH4 (g)+2NO2 (g)═N2 (g)+CO2 (g)+2H2 O(g)△H=-867 kJ•mol-1 | |
| B. | CH4 (g)+4NO2 (g)═4NO(g)+CO2 (g)+2H2O(l)△H3<△H1 | |
| C. | 若用0.2 mol CH4还原NO2至N2,则反应中放出的热量一定为173.4 kJ | |
| D. | 若用标准状况下2.24 L CH4还原NO2至N2,整个过程中转移的电子为0.8mol |
7.在一定条件下,向某固定容积的密闭容器中加入1molCO(g)和1molH2O(g),发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g).此反应达到平衡的标志是( )
| A. | 体系的总压强不变 | |
| B. | 体系内各物质的质量分数不再发生变化 | |
| C. | 体系内气体密度不再发生变化 | |
| D. | 单位时间消耗0.1molCO(g)的同时生成0.1molH2O(g) |
2.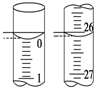 环境监测测定水中溶解氧的方法是:
环境监测测定水中溶解氧的方法是:
①量取25mL水样,迅速加入固定剂MnSO4溶液和碱性KI溶液(含KOH),立即塞好瓶塞,反复振荡,使之充分反应,其反应式为:2Mn2++O2+4OH-=2MnO(OH)2(该反应极快)
②测定:开塞后迅速加入1mL~2mL浓硫酸(提供H+),使之生成I2,再用0.1000mol/L的Na2S2O3溶液滴定(以淀粉为指示剂),消耗VmL. 有关反应式为:MnO(OH)2+2I-+4H+=Mn2++I2+3H2O I2+2S2O32-=2I-+S4O62-.
请填写下列空白:
(1)用标准的Na2S2O3溶液滴定待测溶液时,左手握滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色变化,直到因加入一滴Na2S2O3溶液后,溶液由蓝色变为无色,且在半分钟内不变色为止.
(2)若滴定开始和结束时,碱式滴定管中的液面如图所示,则所
用Na2S2O3溶液的体积为26.10mL.
(3)下列操作中引起的误差偏低的是A、D(填字母序号).
A.读数:滴定前平视,滴定后俯视
B.未用标准液润洗滴定管
C.用固体配制Na2S2O3溶液时,其固体中含有对反应体系无影响的杂质
D.待测液的滴定管之前有气泡,取液后无气泡
(4)某学生根据3次实验分别记录有关数据如下表:
依据上表数据列式计算水中溶解氧的量(以g/L为单位,保留4位有效数字).
 环境监测测定水中溶解氧的方法是:
环境监测测定水中溶解氧的方法是:①量取25mL水样,迅速加入固定剂MnSO4溶液和碱性KI溶液(含KOH),立即塞好瓶塞,反复振荡,使之充分反应,其反应式为:2Mn2++O2+4OH-=2MnO(OH)2(该反应极快)
②测定:开塞后迅速加入1mL~2mL浓硫酸(提供H+),使之生成I2,再用0.1000mol/L的Na2S2O3溶液滴定(以淀粉为指示剂),消耗VmL. 有关反应式为:MnO(OH)2+2I-+4H+=Mn2++I2+3H2O I2+2S2O32-=2I-+S4O62-.
请填写下列空白:
(1)用标准的Na2S2O3溶液滴定待测溶液时,左手握滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色变化,直到因加入一滴Na2S2O3溶液后,溶液由蓝色变为无色,且在半分钟内不变色为止.
(2)若滴定开始和结束时,碱式滴定管中的液面如图所示,则所
用Na2S2O3溶液的体积为26.10mL.
(3)下列操作中引起的误差偏低的是A、D(填字母序号).
A.读数:滴定前平视,滴定后俯视
B.未用标准液润洗滴定管
C.用固体配制Na2S2O3溶液时,其固体中含有对反应体系无影响的杂质
D.待测液的滴定管之前有气泡,取液后无气泡
(4)某学生根据3次实验分别记录有关数据如下表:
| 滴定次数 | 待测液的体积/mL | 0.1000mol•L-1 Na2S2O3的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
20.NA表示阿伏加德罗常数的值,下列有关说法正确的是( )
| A. | 1L1mol/L的甲醇水溶液中含有氢原子总数为4NA | |
| B. | 50mL18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA | |
| C. | 反应KIO3+6HI═KI+3H2O+3I2中,生成3molI2转移电子的总数为5NA | |
| D. | 12g石墨和C60的混合物中质子总数为12NA |



 +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$ +NaBr.
+NaBr.