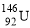题目内容
7.一定条件下,用甲烷可以消除氮的氧化物(NOx)的污染.已知:①CH4(g)+4NO2 (g)═4NO(g)+CO2 (g)+2H2 O(g)△H1=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2 (g)+CO2 (g)+2H2 O(g)△H2=-1160kJ•mol-1
下列选项不正确的是( )
| A. | CH4 (g)+2NO2 (g)═N2 (g)+CO2 (g)+2H2 O(g)△H=-867 kJ•mol-1 | |
| B. | CH4 (g)+4NO2 (g)═4NO(g)+CO2 (g)+2H2O(l)△H3<△H1 | |
| C. | 若用0.2 mol CH4还原NO2至N2,则反应中放出的热量一定为173.4 kJ | |
| D. | 若用标准状况下2.24 L CH4还原NO2至N2,整个过程中转移的电子为0.8mol |
分析 A.由盖斯定律可知,反应①+②可得到2CH4(g)+4NO2(g)═2N2(g)+2CO2(g)+4H2O( g );
B.水蒸气变为液态的水是放热过程;
C.热化学反应方程式中表示物质完全转化时的能量变化;
D.结合n=$\frac{m}{M}$及C元素的化合价变化计算转化电子.
解答 解:A.反应①+②可得到2CH4(g)+4NO2(g)═2N2(g)+2CO2(g)+4H2O( g ),可知△H=(-574kJ•mol-1)+(-1160kJ•mol-1)=-1734kJ•mol-1,则CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O( g )△H=-867kJ•mol-1,故A正确;
B.水蒸气变为液态的水是放热过程,所以生成液态的水放出的热量更多,但是焓变是负值,所以△H3<△H1,故B正确;
C.由CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O( g )△H=-867kJ•mol-1,放出的热量为0.2mol×867kJ•mol-1=173.4kJ,但是甲烷的反应不一定是完全的,反应有可能存在可逆性,则则反应中放出的热量不一定为173.4 kJ,故C错误;
D.甲烷的物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,碳元素的化合价由-4价升高为+4价,则转移的电子总数为0.1mol×8=0.8mol,故D正确;
故选C.
点评 本题考查反应热与焓变、氧化还原反应,为高频考点,把握盖斯定律的应用、反应中元素的化合价变化等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
20.某有机物M的结构简式如图所示,下列说法正确的是( )
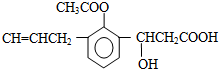

| A. | M中至少有8个碳原子共面 | |
| B. | M能发生还原、氧化、中和、缩聚、取代、加成、银镜等反应 | |
| C. | M中苯环上的一氯取代物有两种不同的结构 | |
| D. | 1molM消耗Na、NaOH、NaHCO3的物质的量的比是2:2:1 |
17.下列有关食品添加剂的叙述中不正确的是( )
| A. | 醋的主要成分是乙酸,可同时用作防腐剂和调味剂 | |
| B. | 亚硝酸钠可能致癌,人们应尽量少吃腌制食物 | |
| C. | 我国应禁止使用味精,避免它对人体健康的损害 | |
| D. | 营养强化剂是补充食品中缺乏的营养成分或微量元素 |
11.化学与生活、社会发展息息相关,下列有关说法不正确的是( )
| A. | “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 | |
| B. | “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 | |
| C. | “玉不琢不成器”,“百炼方能成钢”发生的均为化学变化 | |
| D. | 古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金 |