题目内容
19.综合利用海水资源是一个重要的研究课题,下面是工业上用海水制备食盐、纯碱、金属镁等物质的一种流程如图1: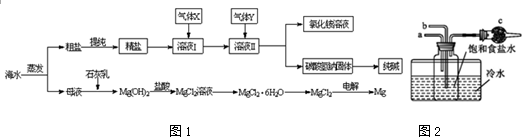
完成下列填空
(1)气体Y是CO2(填化学式),溶液II中发生反应的化学方程式是:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl.实验室可用如图装置模拟此制备过程,仪器c的名称干燥管,反应时a管应通入NH3.
(2)为了测定碳酸氢钠中杂质氯元素的含量,先称取a g试样用蒸馏水溶解,再用足量稀硝酸酸化,配成100mL溶液,取出20mL注入锥形瓶中,然后用c mol/LAgNO3标准溶液滴定Cl-,K2CrO4溶液为指示剂.
已知:常温下Ksp(AgCl)=2×10-10,Ksp(Ag2CrO4)=1.12×10-12,Ag2CrO4为砖红色.
①当Cl-恰好沉淀完全即溶液中残余c(Cl-)=1.0×10-5 mol•L-1,则此时溶液中的c(CrO42-)=2.8×10-3mol•L-1.
②滴定过程中,使用棕色滴定管的原因是防止硝酸银见光分解;当观察到出现砖红色沉淀且在半分钟内不再消失时停止滴定,若此时消耗了AgNO3标准溶液v mL,则碳酸氢钠样品中杂质氯元素的质量分数表达式为$\frac{cv×1{0}^{-3}×5×35.5}{a}×100%$.
③下列情况会造成实验测定结果偏低的是c.
a.盛放AgNO3溶液的滴定管水洗后未用标准液润洗
b.滴定管滴定前尖嘴部分有气泡,滴定后消失
c.滴定前仰视读数,滴定后俯视读数.
分析 由流程图可知,海水可用于制取纯碱,也可用于制备金属镁,制备纯碱时,海水经蒸发、提纯得到精盐,溶于水在水中先通入氨气,然后通入二氧化碳气体,可生成溶解度较小的碳酸氢钠,经过滤、洗涤和加热和得到碳酸钠固体;
海水中含有氯化镁,加入石灰水,可生成氢氧化镁沉淀,过滤后在沉淀中加入盐酸可生成氯化镁,经蒸发、结晶和脱水后可得氯化镁,电解熔融的氯化镁可得金属镁,
(1)制备纯碱,由于氨气易溶于水,而二氧化碳微溶,应在饱和氯化钠溶液中先通入氨气,然后再通入二氧化碳气体,发生NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;
(2)①根据AgCl的Ksp计算c(Ag+),然后计算c(CrO42;
②滴定时先生成AgCl沉淀,当AgCl全部沉淀时,再生成Ag2CrO4砖红色沉淀且半分钟内不再消失,此时可说明达到滴定终点,根据硝酸银的物质的量计算质量分数;
③a.盛放AgNO3溶液的滴定管水洗后未用标准液润洗,导致硝酸银溶液浓度偏低;
b.滴定管滴定前尖嘴部分有气泡,滴定后消失,导致所用体积偏大;
c.滴定前仰视读数,滴定后俯视读数,导致体积偏小.
解答 解:由流程图可知,海水可用于制取纯碱,也可用于制备金属镁,制备纯碱时,海水经蒸发、提纯得到精盐,溶于水在水中先通入氨气,然后通入二氧化碳气体,可生成溶解度较小的碳酸氢钠,经过滤、洗涤和加热和得到碳酸钠固体;
海水中含有氯化镁,加入石灰水,可生成氢氧化镁沉淀,过滤后在沉淀中加入盐酸可生成氯化镁,经蒸发、结晶和脱水后可得氯化镁,电解熔融的氯化镁可得金属镁,
(1)制备纯碱,由于氨气易溶于水,而二氧化碳微溶,应在饱和氯化钠溶液中先通入氨气,然后在通入二氧化碳气体,发生NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,
如用题给图装置制备,由于氨气易溶于水,为防止倒吸,则a通入氨气,仪器c为干燥管,
故答案为:CO2;NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;干燥管;NH3;
(2)①Cl-恰好沉淀完全即溶液中残余c(Cl-)=1.0×10-5 mol•L-1,c(Ag+)=$\frac{Ksp}{c(C{l}^{-})}$=$\frac{2×1{0}^{-10}}{1.0×1{0}^{-5}}$=2.0×10-5mol/L,
则此时溶液中的c(CrO42-)=$\frac{Ksp}{{c}^{2}(A{g}^{+})}$=$\frac{1.12×1{0}^{-12}}{(2.0×1{0}^{-5})^{2}}$=2.8×10-3;
故答案为:2.8×10-3;
②析出沉淀时,AgCl溶液中c(Ag+)=$\frac{{K}_{sp}(AgCl)}{c(C{l}^{-})}$=$\frac{1.56×1{0}^{-10}}{0.01}$mol/L=1.56×10-8mol/L,
Ag2CrO4溶液中c(Ag+)=$\sqrt{\frac{{K}_{sp}(A{g}_{2}Cr{O}_{4})}{c({Cr{O}_{4}}^{2-})}}$=$\sqrt{\frac{9.0×1{0}^{-12}}{0.01}}$mol/L=3×10-5,
则滴定时先生成AgCl沉淀,当AgCl全部沉淀时,再生成Ag2CrO4砖红色沉淀且半分钟内不再消失,此时可说明达到滴定终点,由于硝酸银见光易分解,应放在棕色滴定管内,
若此时消耗了AgNO3标准溶液v mL,则n(AgNO3)=cv×10-3mol,可知n(Cl-)=cv×10-3mol,
因配成100mL溶液,取出20mL注入锥形瓶中,则原样品中含有n(Cl-)=5cv×10-3mol,
则质量分数为$\frac{cv×1{0}^{-3}×5×35.5}{a}×100%$,
故答案为:防止硝酸银见光分解;砖红色沉淀且在半分钟内不再消失;$\frac{cv×1{0}^{-3}×5×35.5}{a}×100%$;
③a.盛放AgNO3溶液的滴定管水洗后未用标准液润洗,导致硝酸银溶液浓度偏低,所用体积偏大,则测定及结果偏高,故a错误;
b.滴定管滴定前尖嘴部分有气泡,滴定后消失,导致所用体积偏大,则测定及结果偏高,故b错误;
c.滴定前仰视读数,滴定后俯视读数,导致体积偏小,则测定结果偏小,故c正确.
故答案为:c.
点评 本题主要考查较为综合,涉及粗盐的提纯、候氏制碱、海水中提取Mg的原理以及含量的测定,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握实验的原理和操作方法,难度中等.

| A. | 中子数为6 | B. | 质子数为8 | C. | 核外电子数为14 | D. | 质量数为14 |
 实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图1所示).
实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图1所示).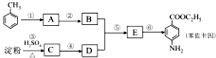 甲苯是一种重要的化工原料,可以参与合成很多物质.如图为以甲苯为原料得到药物苯佐卡因的合成路线.
甲苯是一种重要的化工原料,可以参与合成很多物质.如图为以甲苯为原料得到药物苯佐卡因的合成路线.
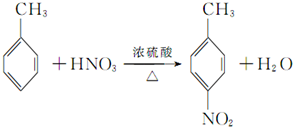 ,该反应要控制好低温条件,否则会生成一种新物质F,该物质是一种烈性炸药,F的名称为2,4,6-三硝基甲苯.
,该反应要控制好低温条件,否则会生成一种新物质F,该物质是一种烈性炸药,F的名称为2,4,6-三硝基甲苯.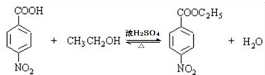 .
.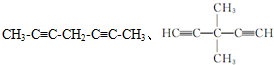 .
.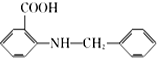 是一种药物中间体,请写出以甲苯为主要原料制备该中间体的合成路线流程图:
是一种药物中间体,请写出以甲苯为主要原料制备该中间体的合成路线流程图: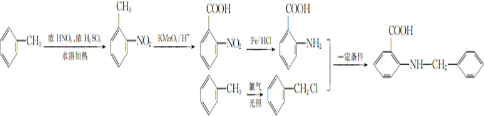 .
.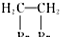
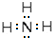 .
.