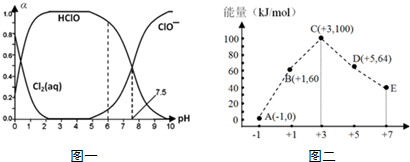
题目内容
2. 环境监测测定水中溶解氧的方法是:
环境监测测定水中溶解氧的方法是:①量取25mL水样,迅速加入固定剂MnSO4溶液和碱性KI溶液(含KOH),立即塞好瓶塞,反复振荡,使之充分反应,其反应式为:2Mn2++O2+4OH-=2MnO(OH)2(该反应极快)
②测定:开塞后迅速加入1mL~2mL浓硫酸(提供H+),使之生成I2,再用0.1000mol/L的Na2S2O3溶液滴定(以淀粉为指示剂),消耗VmL. 有关反应式为:MnO(OH)2+2I-+4H+=Mn2++I2+3H2O I2+2S2O32-=2I-+S4O62-.
请填写下列空白:
(1)用标准的Na2S2O3溶液滴定待测溶液时,左手握滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色变化,直到因加入一滴Na2S2O3溶液后,溶液由蓝色变为无色,且在半分钟内不变色为止.
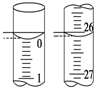
(2)若滴定开始和结束时,碱式滴定管中的液面如图所示,则所
用Na2S2O3溶液的体积为26.10mL.
(3)下列操作中引起的误差偏低的是A、D(填字母序号).
A.读数:滴定前平视,滴定后俯视
B.未用标准液润洗滴定管
C.用固体配制Na2S2O3溶液时,其固体中含有对反应体系无影响的杂质
D.待测液的滴定管之前有气泡,取液后无气泡
(4)某学生根据3次实验分别记录有关数据如下表:
| 滴定次数 | 待测液的体积/mL | 0.1000mol•L-1 Na2S2O3的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
分析 (1)滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视锥形瓶内溶液颜色的变化;碘遇淀粉变蓝,若单质碘被还原完,则蓝色褪去;
(2)滴定管的0刻度在上方,故图1、2正确.0~1刻度间每一小格为0.10mL,如图1显示0.00ml,图2显示26.10ml;
(3)根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析误差;
(4)第2组数据误差较大,舍去,根据第1组和第3组数据计算Na2S2O3的体积平均值;根据关系式:O2~2MnO(OH)2~2I2~4S2O32-可计算水样中溶解氧的浓度.
解答 解:(1)滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视锥形瓶内溶液颜色的变化,碘遇淀粉变蓝,若单质碘被还原完,则蓝色褪去,半分钟不恢复蓝色证明达到滴定终点;
故答案为:锥形瓶中溶液颜色变化;蓝;无;在半分钟内不变色;
(2)滴定管的0刻度在上方,故图1、2正确.0~1刻度间每一小格为0.10mL,如图1显示0.00ml,图2显示26.10ml,可知则所用Na2S2O3溶液的体积为26.10ml-0.00ml=26.10mL,
故答案为:26.10;
(3)A.读数:滴定前读酸液体积时平视,滴定后读酸液体积时俯视,造成V(标准)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析c(待测)偏小,故A正确;
B.未用标准液润洗滴定管,标准液的浓度偏小,消耗的标准液的体积偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析c(待测)偏大,故B错误;
C.用固体配制Na2S2O3溶液时,其固体中含有对反应体系无影响的杂质,造成标准液的浓度偏小,消耗的标准液的体积偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析c(待测)偏大,故C错误;
D.待测液的滴定管之前有气泡,取液后无气泡,导致V(待测)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析c(待测)偏小,故D正确;
故答案为:A、D;
(4)第2组数据误差较大,舍去,根据第1组和第3组数据计算Na2S2O3的体积平均值为:$\frac{26.11+26.09}{2}$mL=26.10mL;
根据反应:2Mn2++O2+4OH-═2MnO(OH)2,MnO(OH)2+2I-+4H+═Mn2-+I2+3H2O,I2+2S2O32-═S4O62-+2I-,可知关系式:
O2~2MnO(OH)2~2I2~4S2O32-
32g 4mol
m 0.1000mol/L×26.10mL×10-3L/mL
m=$\frac{32g×0.1000mol/L×26.10mL×1{0}^{-3}L/mL}{4mol}$=20.88×10-3g,则1L水样含氧气质量为:$\frac{20.88×1{0}^{-3}g}{0.025L}$=0.8352g/L;
答:水中溶解氧的量为0.8352g/L.
点评 本题考查了氧化还原滴定的操作、仪器、误差分析和数据处理,题目难度中等,注意实验的基本操作方法和注意事项.

| A. | 氯化铵 | B. | 硫酸 | C. | 氦气 | D. | 三氧化硫 |
 实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图1所示).
实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图1所示).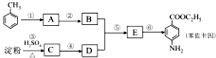 甲苯是一种重要的化工原料,可以参与合成很多物质.如图为以甲苯为原料得到药物苯佐卡因的合成路线.
甲苯是一种重要的化工原料,可以参与合成很多物质.如图为以甲苯为原料得到药物苯佐卡因的合成路线.
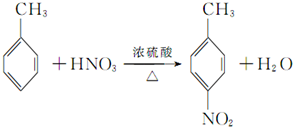 ,该反应要控制好低温条件,否则会生成一种新物质F,该物质是一种烈性炸药,F的名称为2,4,6-三硝基甲苯.
,该反应要控制好低温条件,否则会生成一种新物质F,该物质是一种烈性炸药,F的名称为2,4,6-三硝基甲苯.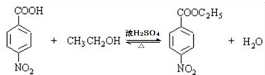 .
.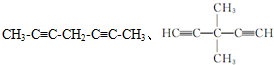 .
.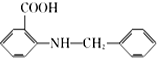 是一种药物中间体,请写出以甲苯为主要原料制备该中间体的合成路线流程图:
是一种药物中间体,请写出以甲苯为主要原料制备该中间体的合成路线流程图: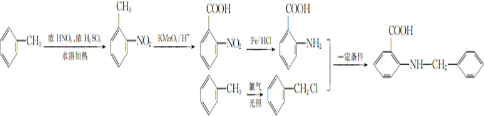 .
.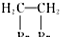
 .
.