��Ŀ����
16�����Ṥҵ�У���Ϊ������V2O5�Է�Ӧ��Ĵ����̾����ˢ�������Ӧ�Σ���ͼ1��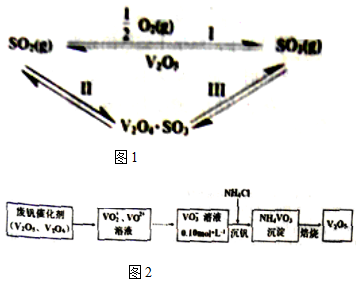
��1�����з�����1mol��ѧ������ʱ��Ҫ���յ��������������
| ��ѧ�� | S=O��SO2�� | S=O��SO3�� | O=O��O2�� |
| ����/kJ | 535 | 472 | 496 |
��2���ӷϷ������л���V2O5�Ĺ�����ͼ2��
��VO2+���ӿ��ɷ�ͬ��̬�ļ���������ȫˮ��õ�����ˮ�ⷴӦ�����ӷ���ʽV4++H2O=VO2++2H+��
�ڡ�������ʱΪʹ��Ԫ�صij����ʴﵽ98%������Ӧ������Һ�е�c��NH4+��Ϊ0.8mol•L-1[25�棬Ksp��NH4VO3��=1.6��10-3����Һ����仯���Բ���]��
��3��������������������ͬʱ����SO2��NOx����ã�NH4��2SO4��ϡ��Һ��
�������Һϡ��Һ���ټ���������NH4��2SO4���壬$\frac{c��N{{H}_{4}}^{+}��}{c��S{{O}_{4}}^{2-}��}$��������������䡱��С������
�ڳ����£�0.05mol/L��NH4��2SO4��Һ��pH=a����$\frac{c��N{{H}_{4}}^{+}��}{c��N{H}_{3}•{H}_{2}O��}$=1.7��10��9-a�����ú�a�Ĵ���ʽ��ʾ��NH3•H2O��Kb=1.7��10-5��
���� ��1����ӦI���Ȼ�ѧ��Ӧ����ʽΪSO2��g��+$\frac{1}{2}$O2��g��=SO3��g����H����Ӧ�ȵ��ڷ�Ӧ����ܼ��ܼ���������ܼ��ܣ�
V2O5�ڷ�Ӧ������������Ӧ������V2O4•SO3��V2O5�μӷ�Ӧ����Ӧ����V2O4•SO3��������Ӧ����V2O5��SO3��
��2����ˮ������VO2+��V�Ļ��ϼ�Ϊ+4�ۣ�����V4+ˮ�����ɣ�
����Һ��c��VO3-��=0.1mol/L��Ϊʹ��Ԫ�صij����ʴﵽ98%���������c��VO3-��=0.002mol/L�����Ksp��NH4VO3��=1.6��10-3���㣻
��3�����ڣ�NH4��2SO4��Һ�д���ˮ�ⷴӦ��NH4++H2O?NH3•H2O+H+������NH4��2SO4��Һ���ټ������� ��NH4��2SO4���壬ˮ��ƽ������������У���笠���ˮ���ʼ�С��
�ڸ���ˮ��ƽ�ⳣ��Kh=$\frac{c��N{H}_{3}•{H}_{2}O��•c��{H}^{+}��}{c��N{{H}_{4}}^{+}��}$=$\frac{c��N{H}_{3}•{H}_{2}O��•c��{H}^{+}��}{c��N{{H}_{4}}^{+}��}$•$\frac{c��O{H}^{-}��}{c��O{H}^{-}��}$=$\frac{{K}_{w}}{{K}_{b}}$���㣮
��� �⣺��1����Ӧ�ȵ��ڷ�Ӧ����ܼ��ܼ���������ܼ��ܣ���ӦI���Ȼ�ѧ��Ӧ����ʽΪSO2��g��+$\frac{1}{2}$O2��g��=SO3��g����H����ӦI�ġ�H=��2��535+$\frac{1}{2}$��496-3��472��kJ/mol=-98kJ/mol��V2O5�ڷ�Ӧ������������Ӧ������V2O4•SO3��V2O5�μӷ�Ӧ������ʽΪSO2+V2O5?V2O4•SO3����Ӧ����V2O4•SO3��������Ӧ����V2O5��SO3��Ӧ������V2O4•SO3������ʽΪ2V2O4•SO3+O2?2V2O5+2SO3��
�ʴ�Ϊ��-98��2V2O4•SO3+O2?2V2O5+2SO3��
��2����ˮ������VO2+��V�Ļ��ϼ�Ϊ+4�ۣ�����V5+ˮ�����ɣ�����ʽΪV4++H2O=VO2++2H+��
�ʴ�Ϊ��V4++H2O=VO2++2H+��
����Һ��c��VO3-��=0.1mol/L��Ϊʹ��Ԫ�صij����ʴﵽ98%���������c��VO3-��=0.002mol/L����Ksp��NH4VO3��=1.6��10-3��֪c��NH4+��=$\frac{1.6��1{0}^{-3}}{0.002}$mol/L=0.8mol/L��
�ʴ�Ϊ��0.8mol/L��
��3�����ڣ�NH4��2SO4��Һ�д���ˮ�ⷴӦ��NH4++H2O?NH3•H2O+H+������NH4��2SO4��Һ���ټ������� ��NH4��2SO4���壬ˮ��ƽ������������У���笠���ˮ���ʼ�С������$\frac{c��N{{H}_{4}}^{+}��}{c��S{{O}_{4}}^{2-}��}$��ֵ�����
�ʴ�Ϊ�����
��ˮ��ƽ�ⳣ��Kh=$\frac{c��N{H}_{3}•{H}_{2}O��•c��{H}^{+}��}{c��N{{H}_{4}}^{+}��}$=$\frac{c��N{H}_{3}•{H}_{2}O��•c��{H}^{+}��}{c��N{{H}_{4}}^{+}��}$•$\frac{c��O{H}^{-}��}{c��O{H}^{-}��}$=$\frac{{K}_{w}}{{K}_{b}}$��pH=a��c��H+��=1��10-a��
��$\frac{c��N{{H}_{4}}^{+}��}{c��N{H}_{3}•{H}_{2}O��}$=$\frac{c��{H}^{+}��}{{K}_{h}}$=$\frac{c��{H}^{+}��•{K}_{b}}{{K}_{w}}$=10-a��$\frac{1.7��1{0}^{-5}}{1��1{0}^{-14}}$=1.7��10��9-a����
�ʴ�Ϊ��1.7��10��9-a����
���� ���⿼�鷴Ӧ�����ʱ�ļ����Լ�����ˮ���Ӧ�ã�Ҫ��ѧ���Ի���֪ʶ��������ʵ��������ѧ���ķ��������������Ŀ��飬ע���������������Ϣ���ѶȽϴ�

 ��У����ϵ�д�
��У����ϵ�д�| A�� | �ձ� | B�� | ����̨������Ȧ�� | C�� | ©�� | D�� | ҩ�� |
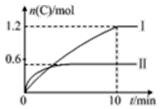 ��2L�ĺ����ܱ������г���A��g����B��g����������ӦA��g��+B��g��?2C��g��+D��s����H=a kJ•mol-1��ʵ�����ݺͽ���ֱ������ͼ��ʾ������˵����ȷ���ǣ�������
��2L�ĺ����ܱ������г���A��g����B��g����������ӦA��g��+B��g��?2C��g��+D��s����H=a kJ•mol-1��ʵ�����ݺͽ���ֱ������ͼ��ʾ������˵����ȷ���ǣ�������| ʵ�� ��� | �¶� | ��ʼ���ʵ��� | ���� �仯 | |
| A | B | |||
| �� | 600�� | 1 mol | 3 mol | 96 kJ |
| �� | 800�� | 1.5 mol | 0.5 mol | -- |
| A�� | ��������ʽ��a=-160 | |
| B�� | ʵ����У�10 min��ƽ������v��B��=0.06 mol•L-1•min-1 | |
| C�� | 600��ʱ���÷�Ӧ��ƽ�ⳣ����0.45 | |
| D�� | ��ʵ����ƽ����ϵ���ٳ���0.5 mol A��1.5 mol B��A��ת���ʼ�С |
| A�� | ��ɫ����һ��ֻ��������� | |
| B�� | ������������Һ�����������ɰ��������ӦΪ6.72L������� | |
| C�� | �������������������ɫ�����У�NH4��2SO4��NH4HSO4�����ʵ���֮��Ϊ1��2 | |
| D�� | ��ij��ɫ������ȷֽ⣬�����������岻��ʹʪ��ĺ�ɫʯ����ֽ��������ù�����һ��������� |
| A�� | 1mol�ǻ���1mol���������������еĵ�����Ŀ��Ϊ9NA | |
| B�� | ��ⱥ��ʳ��ˮ������������2.24L����ʱ��ת�Ƶĵ�����Ϊ0.2NA | |
| C�� | 7.8gNa2O2��Na2S�Ļ�����к��е���������Ϊ0.7NA | |
| D�� | �����£�1L0.1mol/LNa2CO3��Һ�У��������ӵ���������0.3NA |
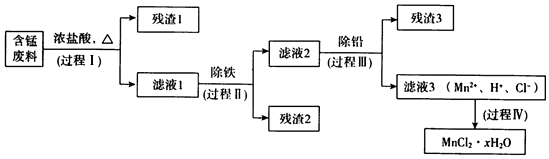
����a��Mn�Ľ������ǿ��Fe��Mn2+�����������±Ƚ��ȶ���pH����5.5ʱ�ױ�O2������
����b��
�����������������pH
| Mn��OH��2 | Pb��OH��2 | Fe��OH��3 | |
| ��ʼ����ʱ | 8.1 | 6.5 | 1.9 |
| ��ȫ����ʱ | 10.1 | 8.5 | 3.2 |
��1������I��Ŀ���ǽ����̣���������Һ1�к��е�������ΪMn2+��Fe3+��Pb2+��H+��
��MnO2��Ũ���ᷴӦ�����ӷ���ʽ��MnO2+4H++2Cl-$\frac{\underline{\;\;��\;\;}}{\;}$Mn2++Cl2��+2H2O��
�ڼ�����Һ1��ֻ��Fe3+����Fe2+�IJ����������ǣ�ȡ������Һ1���Թ��У��������軯����Һ�������Ա仯����ȡ������Һ1���Թ��У��ٵμ�KSCN��Һ����Һ��죮
��Fe3+��Fe2+ת�����ɣ����ܷ����ķ�Ӧ�У�
a.2Fe2++Cl2=2Fe3++2Cl-
b.4Fe2++O2+4H+=4Fe3++2H2O
c����
д��c�����ӷ���ʽ��MnO2+4H++2Fe2+=Mn2++2Fe3++2H2O��
��2�����̢��Ŀ���dz��������������ַ�����
i����ˮ��������Һ1��ϡ�ͣ��ټ�����10%�İ�ˮ�����ˣ�
ii�����շ�������ҺlŨ���õ��Ĺ�����290�決�գ���ȴ��ȡ�����
��֪�������з�������Ҫ��ӦΪ2FeCl3+3O2$\frac{\underline{\;\;��\;\;}}{\;}$2Fe2O3+3Cl2������ʱMnCl2��PbCl2�������仯��
�ٰ�ˮ������ʱ����ҺpHӦ������3.2��6.5֮�䣮
�ڲ�ȫii�еIJ�������ˮ�ܽ⣬���ˣ��ټ������ữ��pHС��6.5��
�����ַ����Ƚϣ���ˮ��������ȱ������������NH4+��
��3�����̢��Ŀ���dz�Ǧ��������Լ����̣�
��4�����̢����ù����е�x�IJⶨ���£�ȡm1g��Ʒ�����ڵ�����Χ�м�����ʧȥȫ���ᾧˮʱ��������Ϊm2g����x=$\frac{{7��{m_1}-{m_2}��}}{m_2}$��
 ��������һ����Ҫ�����ȼ�ϣ�Ҳ�������������������ȣ��Գ��������ƻ����ã���ҵ�Ͽ�����ú���������ˮú�����ϳɶ����ѣ�
��������һ����Ҫ�����ȼ�ϣ�Ҳ�������������������ȣ��Գ��������ƻ����ã���ҵ�Ͽ�����ú���������ˮú�����ϳɶ����ѣ�