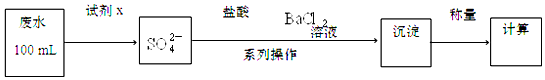
题目内容
11.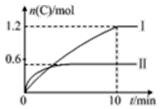 在2L的恒容密闭容器中充入A(g)和B(g),发生反应A(g)+B(g)?2C(g)+D(s)△H=a kJ•mol-1,实验内容和结果分别如表和图所示,下列说法正确的是( )
在2L的恒容密闭容器中充入A(g)和B(g),发生反应A(g)+B(g)?2C(g)+D(s)△H=a kJ•mol-1,实验内容和结果分别如表和图所示,下列说法正确的是( )| 实验 序号 | 温度 | 起始物质的量 | 热量 变化 | |
| A | B | |||
| Ⅰ | 600℃ | 1 mol | 3 mol | 96 kJ |
| Ⅱ | 800℃ | 1.5 mol | 0.5 mol | -- |
| A. | 上述方程式中a=-160 | |
| B. | 实验Ⅰ中,10 min内平均速率v(B)=0.06 mol•L-1•min-1 | |
| C. | 600℃时,该反应的平衡常数是0.45 | |
| D. | 向实验Ⅱ的平衡体系中再充入0.5 mol A和1.5 mol B,A的转化率减小 |
分析 A.根据图象中的变化量结合图表中热量变化计算,依据化学平衡三段式可知,
A(g)+B(g)?2C(g)+D(s)△H=a kJ•mol-1,
起始量(mol) 1 3 0 0 aKJ
变化量(mol) 0.6 0.6 1.2 0.6 96KJ
平衡量(mol) 0.4 2.4 1.2 0.6
反应焓变是指1molA全部反应的热量变化;
B.图象分析可知实验Ⅰ中,10 min内C生成了1.2mol,结合化学反应速率V=$\frac{△c}{△t}$计算,速率之比等于化学方程式计量数之比,以此计算B的反应速率;
C.结合A中化学平衡三段式列式计算平衡浓度,c(A)=0.2mol/L,c(B)=1.2mol/L,c(C)=0.6mol/L,平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积;
D.根据等效平衡分析判断,反应前后气体体积不变,等比等效分析.
解答 解:A.由化学平衡三段式可知,
A(g)+B(g)?2C(g)+D(s)△H=a kJ•mol-1,
起始量(mol) 1 3 0 0 aKJ
变化量(mol) 0.6 0.6 1.2 0.6 96KJ
平衡量(mol) 0.4 2.4 1.2 0.6
反应焓变是指1molA全部反应的热量变化,则a=$\frac{96KJ}{0.6mol}$=160KJ/mol
图象分析,先拐先平温度高,温度越高C物质的量越小,温度升高,平衡逆向进行,说明反应是放热反应,所以a=-160,故A正确;
B.10 min内C生成了1.2mol,则反应速率V(C)=$\frac{\frac{1.2mol}{2L}}{10min}$=0.06mol/L•min,速率之比等于化学方程式计量数之比,V(B)=$\frac{1}{2}$V(C)=0.06mol/L•min×$\frac{1}{2}$=0.03mol/L•min,故B错误;
C.由A中可知平衡浓度:c(A)=0.2mol/L,c(B)=1.2mol/L,c(C)=0.6mol/L,平衡常数K=$\frac{0.{6}^{2}}{0.2×1.2}$=1.5,故C错误;
D.反应前后气体体积不变,等比等效,开始投入量 AB之比为3:1,向实验Ⅱ的平衡体系中再充1.5 mol A和0.5 mol B,可以看作先投入0.5 mol A和1.5 mol B后再投入0.5 mol A和1.5 mol B,两个平衡为等效平衡,则A的转化率不变,故D错误.
故选A.
点评 本题考查化学平衡计算,涉及图象的理解判断、平衡常数、反应速率、等效平衡的计算与分析应用,明确化学平衡及其影响为解答关键,D为易错点,注意掌握等效平衡的应用,试题培养了学生的分析能力及化学计算能力.

| A. | CO燃烧的热化学方程式为2CO(g)+O2(g)═2CO2(g)△H=-282.8kJ•mol-1 | |
| B. | H2燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(g)△H=-571.6kJ•mol-1 | |
| C. | 燃烧前混合气体中CO的体积分数为40% | |
| D. | 燃烧后的产物全部与足量的过氧化钠作用可产生0.125mol O2 |
| A. | ${\;}_{94}^{239}$Pu与${\;}_{94}^{238}$Pu互为同位素 | |
| B. | ${\;}_{94}^{239}$Pu原子核外有94个电子 | |
| C. | ${\;}_{94}^{239}$Pu原子核中有94个中子 | |
| D. | ${\;}_{94}^{239}$Pu与${\;}_{92}^{238}$U为两种不同核素 |
| A. | 钠与盐酸反应最剧烈,产生的氢气最多 | |
| B. | 铝与盐酸反应的速率仅次于钠,产生的气体也没有钠与盐酸反应产生气体多 | |
| C. | 铁与盐酸反应产生的气体比铝与盐酸反应产生的气体多 | |
| D. | 铝与盐酸反应和铁与盐酸反应产生的气体一样多 |
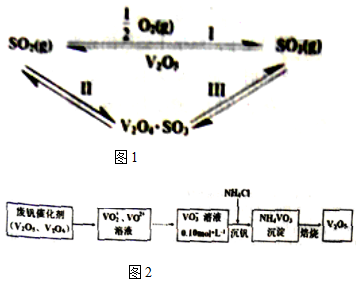
(1)下列分子中1mol化学键断裂时需要吸收的能量数据如表:
| 化学键 | S=O(SO2) | S=O(SO3) | O=O(O2) |
| 能量/kJ | 535 | 472 | 496 |
(2)从废钒催化剂中回收V2O5的过程如图2:
①VO2+离子可由钒同价态的简单阳离子完全水解得到,该水解反应的离子方程式V4++H2O=VO2++2H+.
②“沉钒”时为使钒元素的沉淀率达到98%,至少应调节溶液中的c(NH4+)为0.8mol•L-1[25℃,Ksp(NH4VO3)=1.6×10-3,溶液体积变化忽略不计].
(3)采用脱硫脱硝技术,同时吸收SO2和NOx,获得(NH4)2SO4的稀溶液.
①向此溶液稀溶液中再加入少量(NH4)2SO4固体,$\frac{c(N{{H}_{4}}^{+})}{c(S{{O}_{4}}^{2-})}$将变大(填“变大”、“不变”或“变小”).
②常温下,0.05mol/L(NH4)2SO4溶液的pH=a,则$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$=1.7×10(9-a)(用含a的代数式表示,NH3•H2O的Kb=1.7×10-5)
| A. | 胶体区别于其他分散系的本质特征是分散质的微粒直径在10-5:10-7m之间 | |
| B. | 光线透过胶体时,胶体中可发生丁达尔效应 | |
| C. | Fe(OH)3胶体能够使水中悬浮的固体颗粒沉降,达到净水目的 | |
| D. | 用平行光照射NaCl溶液和Fe(OH)3胶体时,产生的现象相同 |
①质量相同
②碳原子数和氮原子数相等
③所含分子数相等
④所含质子总数相等.
| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①③④ |