题目内容
6.在实验室中进行过滤和蒸发的实验操作,都必须用到的仪器是( )| A. | 烧杯 | B. | 铁架台(带铁圈) | C. | 漏斗 | D. | 药匙 |
分析 过滤操作中需要的仪器有:烧杯,玻璃棒、漏斗、铁架台等,蒸发操作需要的仪器有:酒精灯、铁架台、蒸发皿、玻璃棒等,据此进行解答.
解答 解:过滤时需要制作过滤器的漏斗以及滤纸、固定仪器的铁架台(带铁圈)、引流用的玻璃棒、承接滤液的烧杯,蒸发需要铁架台(带铁圈)、蒸发皿、玻璃棒等仪器,
则共同需要的仪器是铁架台(带铁圈),
故选B.
点评 本题考查分离所用仪器,试题注重了基础知识的考查,题目难度不大,明确各操作所学仪器是解答该题的关键,注意相关基础知识的积累.

练习册系列答案
相关题目
8.下列关于卤素(用X表示)的叙述中正确的是( )
| A. | 卤素单质与水反应的通式为X2+H2O═HX+HXO | |
| B. | HX都极易溶于水,它们的稳定性随核电荷数的增加而增强 | |
| C. | 卤素单质的颜色随相对分子质量的增大而加深 | |
| D. | X2的氧化性随核电荷数的增加而增强 |
6.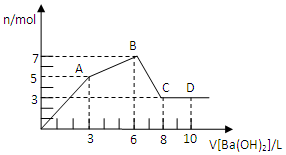 向Al2(SO4)3和AlCl3的混合溶液中逐滴加入1mol/L Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的量的关系如图,下列说法不正确的是( )
向Al2(SO4)3和AlCl3的混合溶液中逐滴加入1mol/L Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的量的关系如图,下列说法不正确的是( )
 向Al2(SO4)3和AlCl3的混合溶液中逐滴加入1mol/L Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的量的关系如图,下列说法不正确的是( )
向Al2(SO4)3和AlCl3的混合溶液中逐滴加入1mol/L Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的量的关系如图,下列说法不正确的是( )| A. | 图中C点铝元素存在的形式是[Al(OH)4]- | |
| B. | 向D点溶液中通入过量CO2气体,立即产生白色沉淀 | |
| C. | 原混合溶液中c[Al2(SO4)3]:c(AlCl3)=1:2 | |
| D. | OA段反应的离子方程式为:2Al3++3SO42-+3Ba2++8OH-═2Al(OH)4-+3BaSO4↓ |
1.已知H2的燃烧热为-285.8kJ•mol-1,CO的燃烧热为-282.8kJ•mol-1;现有H2和CO组成的混合气体5.6L(标准状况),经充分燃烧后,放出总热量为79.5kJ,并生成液态水.下列说法正确的是( )
| A. | CO燃烧的热化学方程式为2CO(g)+O2(g)═2CO2(g)△H=-282.8kJ•mol-1 | |
| B. | H2燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(g)△H=-571.6kJ•mol-1 | |
| C. | 燃烧前混合气体中CO的体积分数为40% | |
| D. | 燃烧后的产物全部与足量的过氧化钠作用可产生0.125mol O2 |
11.甲醛(CH2O)的水溶液叫做“福尔马林”,常用来保存动物标本.下列关于甲醛的叙述中,不正确的是( )
| A. | 一个甲醛分子由1个碳原子、2个氢原子、1个氧原子构成的 | |
| B. | 甲醛中碳、氢、氧三种元素的质量比为1:2:1 | |
| C. | 甲醛由碳、氢、氧三种元素组成的 | |
| D. | 甲醛中氧元素的质量分数为53.3% |
18.在同温、同压下,下列各组热化学方程式中,△H1>△H2的是( )
| A. | 2H2(g)+O2(g)═2H2O(l)△H1 2H2(g)+O2(g)═2H2O(g)△H2 | |
| B. | S(g)+O2(g)═SO2 (g)△H1 S(s)+O2(g)═SO2 (g)△H2 | |
| C. | C(s)+O2(g)═CO(g)△H1 C(s)+O2(g)═CO2(g)△H2 | |
| D. | HCl(g)═H2(g)+Cl2(g)△H1 2HCl(g)═H2(g)+Cl2(g)△H2 |
15.根据下列实验操作和现象所得出的结论错误的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | SO2通入酸性高锰酸钾溶液 | 酸性高锰酸钾溶液褪色 | SO2具有还原性 |
| B | 向NaSiO3溶液的试管中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去 | 2min后,试管里出现凝胶 | 非金属性:Cl>Si |
| C | 将盛有铜片的容器中加入浓硝酸 | 产生大量红棕色气体;溶液变为蓝绿色 | 浓硝酸具有强氧化性 |
| D | 浓硫酸滴到湿润的蔗糖中 | 蔗糖变成黑色海绵状 | 浓硫酸具有脱水性和强氧化性 |
| A. | A | B. | B | C. | C | D. | D |
16.硫酸工业中,作为催化剂的V2O5对反应Ⅰ的催化过程经历了Ⅱ、Ⅲ两个反应阶段,如图1:
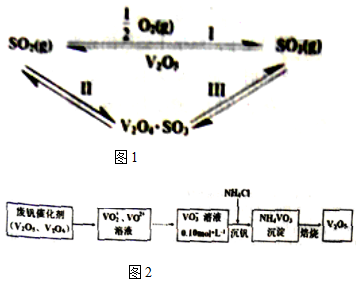
(1)下列分子中1mol化学键断裂时需要吸收的能量数据如表:
则反应I的△H=-98kJ/mol.反应Ⅲ的化学方程式为2V2O4•SO3+O2?2V2O5+2SO3.
(2)从废钒催化剂中回收V2O5的过程如图2:
①VO2+离子可由钒同价态的简单阳离子完全水解得到,该水解反应的离子方程式V4++H2O=VO2++2H+.
②“沉钒”时为使钒元素的沉淀率达到98%,至少应调节溶液中的c(NH4+)为0.8mol•L-1[25℃,Ksp(NH4VO3)=1.6×10-3,溶液体积变化忽略不计].
(3)采用脱硫脱硝技术,同时吸收SO2和NOx,获得(NH4)2SO4的稀溶液.
①向此溶液稀溶液中再加入少量(NH4)2SO4固体,$\frac{c(N{{H}_{4}}^{+})}{c(S{{O}_{4}}^{2-})}$将变大(填“变大”、“不变”或“变小”).
②常温下,0.05mol/L(NH4)2SO4溶液的pH=a,则$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$=1.7×10(9-a)(用含a的代数式表示,NH3•H2O的Kb=1.7×10-5)

(1)下列分子中1mol化学键断裂时需要吸收的能量数据如表:
| 化学键 | S=O(SO2) | S=O(SO3) | O=O(O2) |
| 能量/kJ | 535 | 472 | 496 |
(2)从废钒催化剂中回收V2O5的过程如图2:
①VO2+离子可由钒同价态的简单阳离子完全水解得到,该水解反应的离子方程式V4++H2O=VO2++2H+.
②“沉钒”时为使钒元素的沉淀率达到98%,至少应调节溶液中的c(NH4+)为0.8mol•L-1[25℃,Ksp(NH4VO3)=1.6×10-3,溶液体积变化忽略不计].
(3)采用脱硫脱硝技术,同时吸收SO2和NOx,获得(NH4)2SO4的稀溶液.
①向此溶液稀溶液中再加入少量(NH4)2SO4固体,$\frac{c(N{{H}_{4}}^{+})}{c(S{{O}_{4}}^{2-})}$将变大(填“变大”、“不变”或“变小”).
②常温下,0.05mol/L(NH4)2SO4溶液的pH=a,则$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$=1.7×10(9-a)(用含a的代数式表示,NH3•H2O的Kb=1.7×10-5)
