题目内容
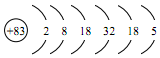
5.以废旧锌锰电池初步处理分选出的含锰废料(MnO2、MnOOH、MnO及少量Fe、Pb等)为原料制备高纯MnCl2•xH2O,实现锰的再生利用.其工作流程如图: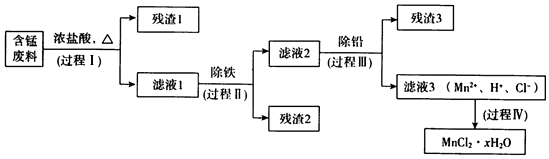
资料a:Mn的金属活动性强于Fe;Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化.
资料b:
生成氢氧化物沉淀的pH
| Mn(OH)2 | Pb(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 8.1 | 6.5 | 1.9 |
| 完全沉淀时 | 10.1 | 8.5 | 3.2 |
(1)过程I的目的是浸出锰.经检验滤液1中含有的阳离子为Mn2+、Fe3+、Pb2+和H+.
①MnO2与浓盐酸反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
②检验滤液1中只含Fe3+不含Fe2+的操作和现象是:取少量滤液1于试管中,滴入铁氰化钾溶液,无明显变化;另取少量滤液1于试管中,再滴加KSCN溶液,溶液变红.
③Fe3+由Fe2+转化而成,可能发生的反应有:
a.2Fe2++Cl2=2Fe3++2Cl-
b.4Fe2++O2+4H+=4Fe3++2H2O
c.…
写出c的离子方程式:MnO2+4H++2Fe2+=Mn2++2Fe3++2H2O.
(2)过程Ⅱ的目的是除铁.有如下两种方法:
i.氨水法:将滤液1先稀释,再加适量10%的氨水,过滤.
ii.焙烧法:将滤液l浓缩得到的固体于290℃焙烧,冷却,取焙烧物…
已知:焙烧中发生的主要反应为2FeCl3+3O2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+3Cl2,焙烧时MnCl2和PbCl2不发生变化.
①氨水法除铁时,溶液pH应控制在3.2~6.5之间.
②补全ii中的操作:加水溶解,过滤,再加盐酸酸化至pH小于6.5.
③两种方法比较,氨水法除铁的缺点是引入杂质NH4+.
(3)过程Ⅲ的目的是除铅.加入的试剂是锰.
(4)过程Ⅳ所得固体中的x的测定如下:取m1g样品,置于氮气氛围中加热至失去全部结晶水时,质量变为m2g.则x=$\frac{{7({m_1}-{m_2})}}{m_2}$.
分析 含锰废料(MnO2、MnOOH、MnO及少量Fe、Pb等)与浓盐酸反应,过滤滤液1中含有的阳离子为Mn2+、Fe3+、Pb2+和H+,过程II除去铁离子,过程III用锰除去铅离子,
(1)①浓盐酸与二氧化锰反应产生氯气;
②检验铁离子用KSCN溶液;
③二氧化锰氧化亚铁离子;
(2)①根据几种离子沉淀的pH数据分析;
②焙烧发除铁:将滤液l浓缩得到的固体于290℃焙烧,冷却,取焙烧物,加水溶解,过滤,再加盐酸酸化至pH小于6.5;
③氨水法除铁滤液2混有铵根离子;
(3)过程Ⅲ的目的是除铅,用活泼金属置换不活泼金属;
(4)m1gMnCl2•xH2O置于氮气氛围中加热至失去全部结晶水时,生成MnCl2质量为m2g,则结晶水的质量为(m1-m2)g,根据1:x=n(MnCl2):n(H2O)计算.
解答 解:(1)①浓盐酸与二氧化锰反应产生氯气,反应为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
②铁离子使KSCN溶液显红色,检验滤液1中只含Fe3+不含Fe2+的操作和现象是:取少量滤液1于试管中,滴入铁氰化钾溶液,无明显变化;另取少量滤液1于试管中,再滴加KSCN溶液,溶液变红;
故答案为:再滴加KSCN溶液,溶液变红;
③Fe3+由Fe2+转化而成,可能由氯气、氧气氧化,也可能由二氧化锰氧化,反应为:MnO2+4H++2Fe2+=Mn2++2Fe3++2H2O;
故答案为:MnO2+4H++2Fe2+=Mn2++2Fe3++2H2O;
(2)①调节pH除去铁离子,pH大于3.2时,铁离子沉淀完全,铅离子、锰离子不能沉淀,故pH应小于6.5;
故答案为:3.2~6.5;
②焙烧法除铁,将滤液l浓缩得到的固体于290℃焙烧,冷却,取焙烧物,加水溶解,过滤,再加盐酸酸化至pH小于6.5;
故答案为:加水溶解,过滤,再加盐酸酸化至pH小于6.5;
③氨水发除铁,除铁过程中,引入杂质NH4+;
故答案为:引入杂质NH4+;
(3)过程Ⅲ的目的是除铅,用活泼金属置换不活泼金属,加入锰,将铅离子置换与溶液分离,自身生成锰离子,不引入杂质;
故答案为:锰;
(4)m1gMnCl2•xH2O置于氮气氛围中加热至失去全部结晶水时,生成MnCl2质量为m2g,则n(MnCl2)=$\frac{{m}_{2}}{131}$nol,结晶水的质量为(m1-m2)g,n(H2O)=$\frac{{m}_{1}-{m}_{2}}{18}$,则1:x=n(MnCl2):n(H2O),解得x=$\frac{{7({m_1}-{m_2})}}{m_2}$;
故答案为:$\frac{{7({m_1}-{m_2})}}{m_2}$.
点评 本题考查了物质制备方案设计,为高频考点,侧重于学生的分析、实验能力的考查,题目涉及离子方程式的书写、物质组成的计算等知识,题目难度中等,注意把握实验的流程、相关物质的性质以及题目信息.

| 选项 | 实验操作 | 实验现象 | 结论 |
| A | SO2通入酸性高锰酸钾溶液 | 酸性高锰酸钾溶液褪色 | SO2具有还原性 |
| B | 向NaSiO3溶液的试管中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去 | 2min后,试管里出现凝胶 | 非金属性:Cl>Si |
| C | 将盛有铜片的容器中加入浓硝酸 | 产生大量红棕色气体;溶液变为蓝绿色 | 浓硝酸具有强氧化性 |
| D | 浓硫酸滴到湿润的蔗糖中 | 蔗糖变成黑色海绵状 | 浓硫酸具有脱水性和强氧化性 |
| A. | A | B. | B | C. | C | D. | D |
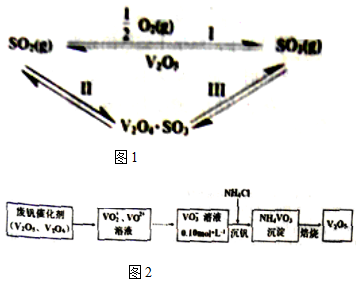
(1)下列分子中1mol化学键断裂时需要吸收的能量数据如表:
| 化学键 | S=O(SO2) | S=O(SO3) | O=O(O2) |
| 能量/kJ | 535 | 472 | 496 |
(2)从废钒催化剂中回收V2O5的过程如图2:
①VO2+离子可由钒同价态的简单阳离子完全水解得到,该水解反应的离子方程式V4++H2O=VO2++2H+.
②“沉钒”时为使钒元素的沉淀率达到98%,至少应调节溶液中的c(NH4+)为0.8mol•L-1[25℃,Ksp(NH4VO3)=1.6×10-3,溶液体积变化忽略不计].
(3)采用脱硫脱硝技术,同时吸收SO2和NOx,获得(NH4)2SO4的稀溶液.
①向此溶液稀溶液中再加入少量(NH4)2SO4固体,$\frac{c(N{{H}_{4}}^{+})}{c(S{{O}_{4}}^{2-})}$将变大(填“变大”、“不变”或“变小”).
②常温下,0.05mol/L(NH4)2SO4溶液的pH=a,则$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$=1.7×10(9-a)(用含a的代数式表示,NH3•H2O的Kb=1.7×10-5)
①质量相同
②碳原子数和氮原子数相等
③所含分子数相等
④所含质子总数相等.
| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①③④ |
| A. | 常温常压下,23gNO2和N2O4混合气体中含O原子数为NA | |
| B. | 1mol/L Al2(SO4)3溶液中含SO42-个数为3NA,含Al3+个数小于2NA | |
| C. | 在标准状况下,将22.4L SO3溶于水配成1L溶液,所得溶液中含SO42-个数为NA | |
| D. | 将1moL 氯气通入到足量水中,则N(HClO)+N(Cl-)+N(ClO-)═2NA |
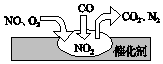 随着我国汽车年销量的大幅增加,空气环境受到了很大的污染.汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )
随着我国汽车年销量的大幅增加,空气环境受到了很大的污染.汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )| A. | 反应中NO为氧化剂,N2为氧化产物 | |
| B. | 汽车尾气的主要污染成分包括CO、NO和N2 | |
| C. | NO和O2必须在催化剂表面才能反应 | |
| D. | 催化转化总化学方程式为2NO+O2+4CO=4CO2+N2 |
 .
.