题目内容
8.用NA表示阿伏伽德罗常数的值.下列叙述正确的是( )| A. | 1mol羟基与1mol氢氧根离子所含有的电子数目均为9NA | |
| B. | 电解饱和食盐水,当阴极产生2.24L气体时,转移的电子数为0.2NA | |
| C. | 7.8gNa2O2和Na2S的混合物中含有的离子总数为0.7NA | |
| D. | 常温下,1L0.1mol/LNa2CO3溶液中,含有离子的总数大于0.3NA |
分析 A.1个羟基含有9个电子,1个氢氧根离子含有10个电子;
B.气体状况未知;
C.1mol过氧化钠和1mol硫化钠都含有3mol离子,二者摩尔质量相同;
D.碳酸根离子为弱酸根离子,部分水解生成碳酸氢根离子和氢氧根离子.
解答 解:A.1mol羟基含有的电子数目均为9NA,1mol氢氧根离子所含有的电子数目为10NA,故A错误;
B.气体状况未知,不能使用气体摩尔体积,故B错误;
C.7.8gNa2O2和Na2S的混合物物质的量为:$\frac{7.8g}{78g/mol}$=0.1mol,共含有0.3mol离子,故C错误;
D.碳酸根离子为弱酸根离子,部分水解生成碳酸氢根离子和氢氧根离子,所以常温下,1L0.1mol/LNa2CO3溶液中,含有离子的总数大于0.3NA,故D正确;
故选;D.
点评 本题考查阿伏加德罗常数的有关计算和判断,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下气体摩尔体积的使用条件,注意过氧化钠、硫化钠的结构,题目难度不大.

练习册系列答案
相关题目
18.在同温、同压下,下列各组热化学方程式中,△H1>△H2的是( )
| A. | 2H2(g)+O2(g)═2H2O(l)△H1 2H2(g)+O2(g)═2H2O(g)△H2 | |
| B. | S(g)+O2(g)═SO2 (g)△H1 S(s)+O2(g)═SO2 (g)△H2 | |
| C. | C(s)+O2(g)═CO(g)△H1 C(s)+O2(g)═CO2(g)△H2 | |
| D. | HCl(g)═H2(g)+Cl2(g)△H1 2HCl(g)═H2(g)+Cl2(g)△H2 |
19.钚(Pu)是一种放射性元素,${\;}_{94}^{239}$Pu是原子能工业的一种重要原料,可作为核燃料和核武器的裂变剂.下列关于Pu-239的说法不正确的是( )
| A. | ${\;}_{94}^{239}$Pu与${\;}_{94}^{238}$Pu互为同位素 | |
| B. | ${\;}_{94}^{239}$Pu原子核外有94个电子 | |
| C. | ${\;}_{94}^{239}$Pu原子核中有94个中子 | |
| D. | ${\;}_{94}^{239}$Pu与${\;}_{92}^{238}$U为两种不同核素 |
16.硫酸工业中,作为催化剂的V2O5对反应Ⅰ的催化过程经历了Ⅱ、Ⅲ两个反应阶段,如图1:
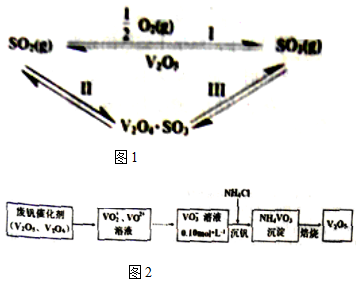
(1)下列分子中1mol化学键断裂时需要吸收的能量数据如表:
则反应I的△H=-98kJ/mol.反应Ⅲ的化学方程式为2V2O4•SO3+O2?2V2O5+2SO3.
(2)从废钒催化剂中回收V2O5的过程如图2:
①VO2+离子可由钒同价态的简单阳离子完全水解得到,该水解反应的离子方程式V4++H2O=VO2++2H+.
②“沉钒”时为使钒元素的沉淀率达到98%,至少应调节溶液中的c(NH4+)为0.8mol•L-1[25℃,Ksp(NH4VO3)=1.6×10-3,溶液体积变化忽略不计].
(3)采用脱硫脱硝技术,同时吸收SO2和NOx,获得(NH4)2SO4的稀溶液.
①向此溶液稀溶液中再加入少量(NH4)2SO4固体,$\frac{c(N{{H}_{4}}^{+})}{c(S{{O}_{4}}^{2-})}$将变大(填“变大”、“不变”或“变小”).
②常温下,0.05mol/L(NH4)2SO4溶液的pH=a,则$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$=1.7×10(9-a)(用含a的代数式表示,NH3•H2O的Kb=1.7×10-5)

(1)下列分子中1mol化学键断裂时需要吸收的能量数据如表:
| 化学键 | S=O(SO2) | S=O(SO3) | O=O(O2) |
| 能量/kJ | 535 | 472 | 496 |
(2)从废钒催化剂中回收V2O5的过程如图2:
①VO2+离子可由钒同价态的简单阳离子完全水解得到,该水解反应的离子方程式V4++H2O=VO2++2H+.
②“沉钒”时为使钒元素的沉淀率达到98%,至少应调节溶液中的c(NH4+)为0.8mol•L-1[25℃,Ksp(NH4VO3)=1.6×10-3,溶液体积变化忽略不计].
(3)采用脱硫脱硝技术,同时吸收SO2和NOx,获得(NH4)2SO4的稀溶液.
①向此溶液稀溶液中再加入少量(NH4)2SO4固体,$\frac{c(N{{H}_{4}}^{+})}{c(S{{O}_{4}}^{2-})}$将变大(填“变大”、“不变”或“变小”).
②常温下,0.05mol/L(NH4)2SO4溶液的pH=a,则$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$=1.7×10(9-a)(用含a的代数式表示,NH3•H2O的Kb=1.7×10-5)
3.下列关于胶体的叙述不正确的是( )
| A. | 胶体区别于其他分散系的本质特征是分散质的微粒直径在10-5:10-7m之间 | |
| B. | 光线透过胶体时,胶体中可发生丁达尔效应 | |
| C. | Fe(OH)3胶体能够使水中悬浮的固体颗粒沉降,达到净水目的 | |
| D. | 用平行光照射NaCl溶液和Fe(OH)3胶体时,产生的现象相同 |
20.关于同温、同压下等体积的N2O和CO2的叙述正确的是( )
①质量相同
②碳原子数和氮原子数相等
③所含分子数相等
④所含质子总数相等.
①质量相同
②碳原子数和氮原子数相等
③所含分子数相等
④所含质子总数相等.
| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①③④ |
17.NA表示阿伏伽德罗常数的值,N代表离子数目,下列说法正确的是( )
| A. | 常温常压下,23gNO2和N2O4混合气体中含O原子数为NA | |
| B. | 1mol/L Al2(SO4)3溶液中含SO42-个数为3NA,含Al3+个数小于2NA | |
| C. | 在标准状况下,将22.4L SO3溶于水配成1L溶液,所得溶液中含SO42-个数为NA | |
| D. | 将1moL 氯气通入到足量水中,则N(HClO)+N(Cl-)+N(ClO-)═2NA |
 ,加聚反应.
,加聚反应.