��Ŀ����
20��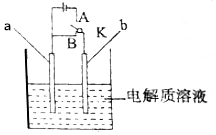 ����ͼ��ʾװ�ý���ʵ�飬��ش��������⣺
����ͼ��ʾװ�ý���ʵ�飬��ش��������⣺��1����K��B���ӣ�a��b���缫���Ϸֱ�ΪCu��Alʱ��
�����������ҺΪNaOH��Һ��������ΪAl���Al����Cu�����������ĵ缫��ӦʽΪ6H2O+6e-=3H2��+6OH-��
�����������ҺΪŨ������Һ��һ��ʱ���������ΪCu���Al����Cu�����������ĵ缫��ӦʽΪCu-2e-=Cu2+��
��2����K��A���ӣ�a��b���缫���Ͼ�Ϊʯī���������ҺΪ����Na2CO3��Һʱ��a�缫�Ϸ������������������ԭ������Ӧ�����һ��ʱ���b�缫���ռ�����״����VL����ʱ����Һ��������mgNa2CO3•10H2O������ǰ��Һ����������Ϊ$\frac{m��\frac{106}{286}}{m+\frac{18V}{22.4}}$��100%����m��V��ʾ���ɣ�
���� ��1���ٵ�K��B���ӣ�����ԭ���װ�ã����������ҺΪ����������Һʱ������������������Һ��Ӧ����ƫ�����ƺ���������ʧ���ӷ���������Ӧ���ܷ�Ӧ��������Ӧʽ�õ�������Ӧ��
�ڵ��������ҺΪŨ������Һ������Ũ���ᷢ���ۻ�����ͭ��������ͭʧ���ӷ���������Ӧ��
��2����K��A���ӣ����ڵ��װ�ã��������ҺΪ����Na2CO3��Һ��a���Դ������������������������ʧ���ӷ���������Ӧ��b���Դ�����������������������ӵõ��ӷ�����ԭ��Ӧ��ʵ���ǵ��ˮ��������Һ���DZ�����Һ������ǰ��Һ����������=$\frac{����̼���Ƶ�����}{�������������+�������ˮ������}$��100%��
��� �⣺��1���ٵ�K��B���ӣ�����ԭ���װ�ã����������ҺΪ����������Һʱ������������������Һ��Ӧ����ƫ�����ƺ��������ܷ�ӦΪ��2Al+2NaOH+2H2O=2NaAlO2+3H2����������������ʧ���ӷ���������Ӧ���缫��ӦΪ��2Al-6e-+8OH-=2AlO2-+4H2O���ܷ�Ӧ��������Ӧʽ�õ�������Ӧ��6H2O+6e-=3H2��+6OH-��
�ʴ�Ϊ��Al��6H2O+6e-=3H2��+6OH-��
�ڵ��������ҺΪŨ������Һ������Ũ���ᷢ���ۻ�����ͭ��������ͭʧ���ӷ���������Ӧ���缫��ӦΪ��Cu-2e-=Cu2+��
�ʴ�Ϊ��Cu��Cu-2e-=Cu2+��
��2����K��A���ӣ����ڵ��װ�ã��������ҺΪ����Na2CO3��Һ��a���Դ������������������������ʧ���ӷ���������Ӧ����������b���Դ�����������������������ӵõ��ӷ�����ԭ��Ӧ����������ʵ���ǵ��ˮ���ܷ�ӦΪ��2H2O$\frac{\underline{\;���\;}}{\;}$2H2��+O2����
���һ��ʱ���b�缫���ռ��������VL����ʱ�����������ʵ���Ϊ��n=$\frac{VL}{22.4L/mol}=\frac{V}{22.4}mol$������ˮ������Ϊ��$\frac{V}{22.4}$mol��18g/mol=$\frac{18V}{22.4}$g��
����mgNa2CO3•10H2O�У�̼���Ƶ�����Ϊ��m��$\frac{106}{286}$g��������Һ���DZ�����Һ��
���ǰ��Һ����������=$\frac{����̼���Ƶ�����}{�������������+�������ˮ������}$��100%=$\frac{m��\frac{106}{286}}{m+\frac{18V}{22.4}}$��100%��
�ʴ�Ϊ��������$\frac{m��\frac{106}{286}}{m+\frac{18V}{22.4}}$��100%��
���� �����ۺϿ���ԭ��غ͵��صĹ���ԭ���������ڿ���ѧ���缫���ж��Լ��缫��Ӧʽ����д����Ŀ�ѶȽϴ����ж�������ʱ����ֻ���ǽ����Ļ����ԣ�Ҫע����յ������Һ�����ʣ�

 ��У����ϵ�д�
��У����ϵ�д�| A�� | Cs��+3�ۣ�I��Cl����-1�� | |
| B�� | ��CsICl2��Һ��ͨ��SO2���壬���������� | |
| C�� | Cs��+1�ۣ�Cl��+1�ۣ�I��-3�� | |
| D�� | ��CsICl2��Һ��ͨ��Cl2���е��ʵ����� |
��1����֪2.00g��C2H2��ȫȼ������Һ̬ˮ�Ͷ�����̼����ų�99.6kJ������д����ʾC2H2ȼ���ȵ��Ȼ�ѧ����ʽC2H2��g��+$\frac{5}{2}$O2��g��=2CO2��g��+H2O��l����H=-1294.8 kJ/mol��
��2������������Ӧ���ȼ�ϵ�أ��������ҺΪ����������Һ����д����ظ����ĵ缫��ӦʽC2H2-10e-+14OH-=2CO32-+8H2O��
��3���û���̿��ԭ��������������йط�ӦΪ��C��s��+2NO��g��N2��g��+CO2��g����ij�о�С����һ�������ݻ�Ϊ3L���ݻ�������ܱ������������������������Բ��ƣ��м���NO�������Ļ���̿���ں��£�T1�棩�����·�Ӧ����ò�ͬʱ�䣨t��ʱ�����ʵ����ʵ�����n�������
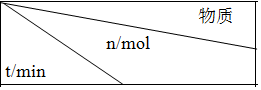 | NO | N2 | CO2 |
| 0 | 2.00 | 0 | 0 |
| 10 | 1.16 | 0.42 | 0.42 |
| 20 | 0.80 | 0.60 | 0.60 |
| 30 | 0.80 | 0.60 | 0.60 |
�����и������жϸ÷�Ӧ�ﵽƽ��״̬����ACE���������ĸ����
A��v��NO��������=2v��N2�����棩 B��������CO2��N2�������Ϊ1��1
C����������ƽ����Է����������ֲ��� D��������ѹǿ���ֲ���
E�����������ܶȱ��ֲ���
��һ���¶��£�����NO����ʼŨ��������NO��ƽ��ת���ʲ��� ������������䡱��С������
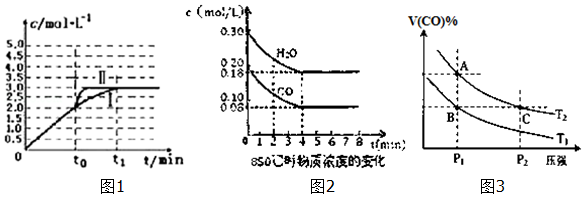
��4����3L�ݻ��ɱ���ܱ������з���������Ӧ��H2��g��+CO2��g��H2O��g��+CO��g����������c��CO���淴Ӧʱ��t�仯�����ߢ���ͼ1��ʾ��
������t0ʱ�ı�һ��������ʹ���ߢ������ߢ���ı�������Ǽ��������
������t0ʱ�̽������������ѹ����2L�������������䣩������ͼ1�л���c��CO���淴Ӧʱ��t�仯�����ߣ�
��5����֪��CO��g��+H2O��g��H2��g��+CO2��g����H=-41.2kJ/mol��850��ʱ��һ���Ϊ10L�ĺ����ܱ������У�ͨ��һ������CO��H2O��CO��H2OŨ�ȱ仯��ͼ2��ʾ������˵����ȷ����B������ţ�
A���ﵽƽ��ʱ�����������ʵ�����0.12mol
B���ﵽƽ��ʱ����Ӧ��ϵ���ջ�ų�49.44kJ����
C����6minʱ���������¶ȣ���Ӧ�����ƶ�
D����8minʱ�������뺤�����ᵼ��v����CO����v����H2O��
��6��ͼ3��ʾ���¶ȷֱ�ΪT1��T2ʱ��ƽ����ϵ��CO�����������ѹǿ�仯���ߣ�A��C����ķ�Ӧ����A��C�����������=����������ͬ������״̬B��״̬A���ɲ������µķ���������¡����¡�����
| A�� | 140��ʱ����ˮ�Ҵ���Ũ���Ṳ�ȿ��Ʊ���ϩ | |
| B�� | ����֬�м�ϡ������֮���ȿɷ���������Ӧ | |
| C�� | ���õ���Һ��������Ƿ�ˮ����ȫ | |
| D�� | ��֤�������е���Ԫ�أ���ֱ�Ӽ�AgNO3��Һ�۲��Ƿ��е���ɫ�������� |
| ѡ�� | X | Y | Z | M |
| A | Fe��s�� | FeCl2 | FeCl3 | Cl2 |
| B | NaOH��aq�� | Na2CO3 | NaHCO3 | CO2 |
| C | NH3��g�� | NO | NO2 | O2 |
| D | NaOH | NOAlO2 | Al��OH��3 | AlCl3 |
| A�� | A | B�� | B | C�� | C | D�� | D |
| A�� | NaHCO3+HCl�TNaCl+H2O+CO2�� | B�� | 2KClO3$\frac{\underline{\;MnO_{2}\;}}{��}$ 2KCl+2O2�� | ||
| C�� | S+O2$\frac{\underline{\;��ȼ\;}}{\;}$SO2 | D�� | 2CuO+C$\frac{\underline{\;\;��\;\;}}{\;}$2Cu+CO2 |
| A�� | 25�棬pH=13��NaOH��Һ�к���OH-����ĿΪ0.1NA | |
| B�� | �����£�1 L 0.1 mol•L-1��NH4NO3��Һ�е�ԭ����Ϊ0.2NA | |
| C�� | 10 L pH=1��������Һ�к��е�H+Ϊ2NA | |
| D�� | ������1.00 L 1.00 mol•L-1��NaCl��Һ���ɽ�58.5 g NaCl����1.00 Lˮ�� |
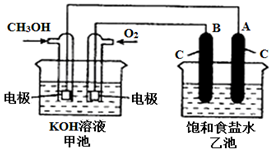 �״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ������ͼ���ü״�ȼ�ϵ�ص�ⱥ��ʳ��ˮ��װ��ʾ��ͼ����֪�׳ص��ܷ�ӦʽΪ��2CH3OH+3O2+4KOH�T2K2CO3+6H2O��
�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ������ͼ���ü״�ȼ�ϵ�ص�ⱥ��ʳ��ˮ��װ��ʾ��ͼ����֪�׳ص��ܷ�ӦʽΪ��2CH3OH+3O2+4KOH�T2K2CO3+6H2O��