题目内容
8.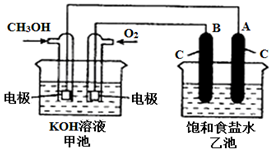 甲醇是一种可再生能源,具有广泛的开发和应用前景.如图是用甲醇燃料电池电解饱和食盐水的装置示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O.
甲醇是一种可再生能源,具有广泛的开发和应用前景.如图是用甲醇燃料电池电解饱和食盐水的装置示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O.请回答下列问题
(1)甲池是原电池装置(池),通入CH3OH的电极名称是负极(填“正极”或“负极”);通入O2的一极的电极反应式为:O2+2H2O+4e-═4OH-;
(2)乙池中A是阴极(填“阴”或“阳”); B电极上产生的物质可用可用湿润的淀粉碘化钾试纸来检验氯气来检验.
(3)乙池中的总反应化学方程式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑;
(4)反应结束后乙池中A(石墨)电极上共收集到气体0.1mol,则甲池中理论上消耗O21120 mL(标准状况下).
(5)若将乙池中的NaCl溶液换成AgNO3溶液,B电极上发生的电极反应:4OH--4e-═O2↑+2H2O.
分析 (1)甲池是燃料电池是原电电池装置,通入燃料CH3OH是负极;通入O2的电极是正极,所以电极反应式:O2+2H2O+4e-═4OH-;
(2)乙池中A是与燃料电池的负极相连,所以A是阴极;B极与电源的正极相连,所以C是阳极;
(3)乙池是电解饱和食盐水,反应的总反应的化学方程式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑;
(4)活泼金属作为阳极,金属本身放电生成铜离子;
(5)乙池中A电极上析出氢气,根据转移电子数相等计算消耗氧气的量.
解答 解:(1)甲池是燃料电池是原电电池装置,通入燃料CH3OH是负极;通入O2的电极是正极,所以电极反应式:O2+2H2O+4e-═4OH-,故答案为:原电池;负极、O2+2H2O+4e-═4OH-;
(2)乙池中A是与燃料电池的负极相连,所以A是阴极;B极与电源的正极相连,所以C是阳极,电极反应式为:2Cl--2e-=Cl2,可用湿润的淀粉碘化钾试纸来检验氯气,故答案为:阴; 可用湿润的淀粉碘化钾试纸来检验氯气;
(3)乙池是电解饱和食盐水,反应的总反应的化学方程式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,故答案为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑;
(4)乙池中A电极上析出氢气,A(石墨)电极上共收集到气体0.1mol,则整个回路上转移电子的物质的量为0.2mol,所以甲池中理论上消耗O2的物质的量为:$\frac{0.2}{4}$=0.05mol,所以体积为:0.05mol×22.4L/mol=1.12L,所以为1120mL,故答案为:1120;
(5)B是阳极硝酸银离子中的氢氧根离子放电,生成氧气,电极反应式为:4OH--4e-═O2↑+2H2O,故答案为:4OH--4e-═O2↑+2H2O.
点评 本题考查了原电池和电解池原理,涉及电极反应式的书写、热化学反应方程式、物质的量的计算等知识点,这些知识点都是考试热点,根据串联电路中转移电子相等进行计算,难点是电极反应式的书写,题目难度中等.

| A. | 物质的量是一个基本物理量,表示物质所含粒子的多少 | |
| B. | 1mol氢中含有2mol氢原子和2mol电子 | |
| C. | 1molH2O的质量等于NA 个H2O 分子的质量总和 | |
| D. | 硫酸的摩尔质量是98g |
| 化学键 | H-H | Br-Br | H-Br |
| 键能/(kJ•mol-1) | 436 | 193 | 366 |
| A. | +103 kJ•mol-1 | B. | +679 kJ•mol-1 | C. | -103 kJ•mol-1 | D. | +183 kJ•mol-1 |
| A. | 常温下都是液体 | B. | 都能在空气中燃烧 | ||
| C. | 都能使酸性高锰酸钾溶液褪色 | D. | 都能发生取代反应 |
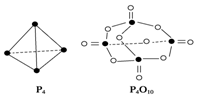 白磷与氧气可发生如下反应:P4+5O2═P4O10已知断裂下列化学键需要吸收的能量分别 为P-O:a kJ•mol-1、P-P:b kJ•mol-1、P═O:c kJ•mol-1 O═O:d kJ•mol-1.根据如图所示的分子结构和有关数据估算该反应的△H,其中正确的是( )
白磷与氧气可发生如下反应:P4+5O2═P4O10已知断裂下列化学键需要吸收的能量分别 为P-O:a kJ•mol-1、P-P:b kJ•mol-1、P═O:c kJ•mol-1 O═O:d kJ•mol-1.根据如图所示的分子结构和有关数据估算该反应的△H,其中正确的是( )| A. | (6b+5d-4c-12a) kJ•mol-1 | B. | (4b+5d-4c-12a) kJ•mol-1 | ||
| C. | (4c+12a-4b-5d) kJ•mol-1 | D. | (4c+12a-6b-5d) kJ•mol-1 |
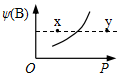 现有mA(s)+nB(g)?qC(g);△H<0的可逆反应,在一定温度下达平衡时,B的体积分数ψ(B)和压强P的关系如图所示,则下列有关该反应的描述正确的是( )
现有mA(s)+nB(g)?qC(g);△H<0的可逆反应,在一定温度下达平衡时,B的体积分数ψ(B)和压强P的关系如图所示,则下列有关该反应的描述正确的是( )| A. | m+n<q | B. | n>q | ||
| C. | x点比y点的正反应速率小 | D. | x点的混合物中v(正)<v(逆) |
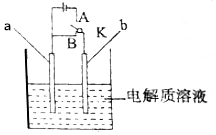 用如图所示装置进行实验,请回答下列问题:
用如图所示装置进行实验,请回答下列问题: