题目内容
6.设NA为阿伏加德罗常数的值,下列叙述中正确的是( )| A. | 25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| B. | 常温下,1 L 0.1 mol•L-1的NH4NO3溶液中氮原子数为0.2NA | |
| C. | 10 L pH=1的硫酸溶液中含有的H+为2NA | |
| D. | 欲配制1.00 L 1.00 mol•L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中 |
分析 A.溶液体积未知;
B.依据原子个数守恒解答;
C.pH=1硫酸溶液中氢离子物质的量浓度为0.1mol/L;
D.物质的量浓度中体积为溶液的体积.
解答 解:A.溶液体积未知,无法计算溶液中离子个数,故A错误;
B.1mol硝酸铵中含有2mol氮原子,所以1 L 0.1 mol•L-1的NH4NO3溶液中含有硝酸铵的物质的量为0.1mol,氮原子数为0.2NA,故B正确;
C.10 L pH=1的硫酸溶液中含有的H+为0.1mol/L×1L×NA=NA,故C错误;
D.可将58.5 g NaCl溶于1.00 L水中,溶液体积大于1L,溶液浓度小于 1.00 mol•L-1,故D错误;
故选:B.
点评 本题考查阿伏加德罗常数的有关计算和判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系是解题关键,注意物质的量浓度概念的理解,题目难度不大.

练习册系列答案
相关题目
19.通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.现给出化学键的键能(见表):
请计算H2(g)+Br2(g)═2HBr(g)的反应热( )
| 化学键 | H-H | Br-Br | H-Br |
| 键能/(kJ•mol-1) | 436 | 193 | 366 |
| A. | +103 kJ•mol-1 | B. | +679 kJ•mol-1 | C. | -103 kJ•mol-1 | D. | +183 kJ•mol-1 |
17.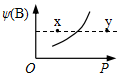 现有mA(s)+nB(g)?qC(g);△H<0的可逆反应,在一定温度下达平衡时,B的体积分数ψ(B)和压强P的关系如图所示,则下列有关该反应的描述正确的是( )
现有mA(s)+nB(g)?qC(g);△H<0的可逆反应,在一定温度下达平衡时,B的体积分数ψ(B)和压强P的关系如图所示,则下列有关该反应的描述正确的是( )
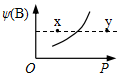 现有mA(s)+nB(g)?qC(g);△H<0的可逆反应,在一定温度下达平衡时,B的体积分数ψ(B)和压强P的关系如图所示,则下列有关该反应的描述正确的是( )
现有mA(s)+nB(g)?qC(g);△H<0的可逆反应,在一定温度下达平衡时,B的体积分数ψ(B)和压强P的关系如图所示,则下列有关该反应的描述正确的是( )| A. | m+n<q | B. | n>q | ||
| C. | x点比y点的正反应速率小 | D. | x点的混合物中v(正)<v(逆) |
1.一定条件下,一种反应物过量,另一种反应物仍不能完全反应的是( )
| A. | 过量的铁与浓硝酸 | B. | 过量的浓盐酸与二氧化锰 | ||
| C. | 过量的铜与浓硫酸 | D. | 过量的锌与18mol/L硫酸 |
18.NA代表阿伏加德罗常数的值,下列叙述不正确的是( )
| A. | 常温下,100 mL 1 mol•L-1 FeCl3溶液中含有Fe3+数目小于0.1NA | |
| B. | 1 mol-OH和17 g NH3所含的电子数相等 | |
| C. | 标准状况下,2.24 L Cl2与过量铁粉反应,转移的电子总数为2NA | |
| D. | 常温下,23 g NO2和N2O4的混合气体中含有NA个氧原子 |
15.铝在人体中积累可使人慢性中毒,1989年世界卫生组织正式将铝确定为食品污染源之一而加以控制.铝在下列使用场合须加以控制的是( )
①制铝锭 ②制易拉罐 ③制电线电缆 ④制牙膏皮 ⑤用明矾净水
⑥制炊具 ⑦用明矾和苏打作食物膨化剂 ⑧用氢氧化铝制药片治胃病 ⑨制防锈油漆.
①制铝锭 ②制易拉罐 ③制电线电缆 ④制牙膏皮 ⑤用明矾净水
⑥制炊具 ⑦用明矾和苏打作食物膨化剂 ⑧用氢氧化铝制药片治胃病 ⑨制防锈油漆.
| A. | ①②④⑤⑥⑦⑧ | B. | ②⑤⑥⑦⑧ | C. | ②④⑤⑥⑦⑧ | D. | ③④⑤⑥⑦⑧ |
16.NA代表阿伏加德罗常数.下列有关叙述正确的是( )
| A. | 1molNa2O2与足量二氧化碳反应转移的电子数为2 NA | |
| B. | 标准状况下22.4L CCl4所含的原子数为5NA | |
| C. | 56g Fe与任何物质完全反应时转移的电子数一定为2NA | |
| D. | 1mol镁与足量氧气或氮气反应均失去2NA的电子 |
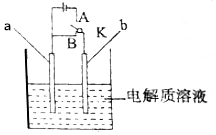 用如图所示装置进行实验,请回答下列问题:
用如图所示装置进行实验,请回答下列问题: