��Ŀ����
7�����������dz��õ�Ư���ͷ���������ͨ�����з�Ӧ�Ʊ���SO2+NaOH��NaHSO32NaHSO3+Na2CO3��2Na2SO3+CO2��+H2O��1��200 mL1.00mol/LNaOH��Һ��NaOH0.2mol��
��2��11.2L����״����SO2��NaOH��Һ��Ӧ��������������0.5mol��
��3��SO2ͨ��NaOH��Һ��Ҳ���ܷ�����ӦSO2+2NaOH��Na2SO3+H2O����һ����SO2ͨ�뺬��6molNaOH����Һ��ַ�Ӧ���ڷ�Ӧ�����Һ����μ���Na2CO3��Һ�����������岻�ٲ��������ų�2molCO2����������Na2SO3��������̼Ԫ���غ��֪�μӷ�Ӧ��Na2CO3Ϊ2mol������SԪ��ȫ����Na2SO3��ʽ���ڣ������������غ㣬��������n��Na2SO3��=n��Na2CO3��+$\frac{1}{2}$n��NaOH��=2mol+$\frac{1}{2}$��6mol=5mol��������Ϊ5mol��126g/mol=630g��������������Na2SO3������Ϊ630g��д��������̣���
���� ��1������n=cV�����������Ƶ����ʵ�����
��2��11.2L����״����SO2�����ʵ���Ϊ0.5mol����NaOH��Һ��Ӧ���������غ㣬���������������ε����ʵ���Ϊ0.5mol��
��3����һ����SO2ͨ�뺬6mol NaOH����Һ����ȫ��Ӧ���ټ������Na2CO3�����ȷų�2mol CO2��˵����NaHSO3��Na2CO3��Ӧ����NaOH��ȫ��Ӧ������SԪ��ȫ����Na2SO3��ʽ���ڣ������������غ������������Na2SO3�����ʵ���������������������
��� �⣺��1��n=cV=0.2L��1.00mol/L=0.2mol���ʴ�Ϊ��0.2��
��2��11.2L����״����SO2�����ʵ���Ϊ0.5mol����NaOH��Һ��Ӧ���������غ㣬���������������ε����ʵ���Ϊ0.5mol���ʴ�Ϊ��0.5��
��3����һ����SO2ͨ�뺬6mol NaOH����Һ����ȫ��Ӧ���ټ������Na2CO3�����ȷų�2mol CO2��˵����NaHSO3��Na2CO3��Ӧ����NaOH��ȫ��Ӧ����̼Ԫ���غ��֪�μӷ�Ӧ��Na2CO3Ϊ2mol������SԪ��ȫ����Na2SO3��ʽ���ڣ������������غ㣬��������n��Na2SO3��=n��Na2CO3��+$\frac{1}{2}$n��NaOH��=2mol+$\frac{1}{2}$��6mol=5mol��������Ϊ5mol��126g/mol=630g��
�ʴ�Ϊ����̼Ԫ���غ��֪�μӷ�Ӧ��Na2CO3Ϊ2mol������SԪ��ȫ����Na2SO3��ʽ���ڣ������������غ㣬��������n��Na2SO3��=n��Na2CO3��+$\frac{1}{2}$n��NaOH��=2mol+$\frac{1}{2}$��6mol=5mol��������Ϊ5mol��126g/mol=630g��������������Na2SO3������Ϊ630g��
���� ���⿼�������йؼ��㣬�ؼ����������ɶ�����̼�ķ�Ӧ�ж�NaOH��ȫ��Ӧ��ע�������غ㷨�����𣬽Ϻõؿ���ѧ����������������

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�| A�� | �����£�100 mL 1 mol•L-1 FeCl3��Һ�к���Fe3+��ĿС��0.1NA | |
| B�� | 1 mol-OH��17 g NH3�����ĵ�������� | |
| C�� | ��״���£�2.24 L Cl2��������۷�Ӧ��ת�Ƶĵ�������Ϊ2NA | |
| D�� | �����£�23 g NO2��N2O4�Ļ�������к���NA����ԭ�� |
�������� ���������� ���Ƶ��ߵ��� ��������Ƥ ����������ˮ
���ƴ��� �����������մ���ʳ���� ��������������ҩƬ��θ�� ���Ʒ������ᣮ
| A�� | �٢ڢܢݢޢߢ� | B�� | �ڢݢޢߢ� | C�� | �ڢܢݢޢߢ� | D�� | �ۢܢݢޢߢ� |
| A�� | 2AlCl3�����ڣ�$\frac{\underline{\;ͨ��\;}}{\;}$ 2Al+3Cl2�� | B�� | 2NaCl�����ڣ�$\frac{\underline{\;ͨ��\;}}{\;}$ 2Na+Cl2�� | ||
| C�� | Fe2O3+3CO $\frac{\underline{\;����\;}}{\;}$2Fe+3CO2 | D�� | 2HgO $\frac{\underline{\;\;��\;\;}}{\;}$2Hg+O2�� |
| A�� | �Ȼ�����������ˮ | B�� | ��������ľ̿���� | ||
| C�� | ���������ʹ��ֽ� | D�� | �Ȼ������� |
| A�� | �̶��� | B�� | ������ | C�� | Ũ�� | D�� | �¶� |
| A�� | 1molNa2O2������������̼��Ӧת�Ƶĵ�����Ϊ2 NA | |
| B�� | ��״����22.4L CCl4������ԭ����Ϊ5NA | |
| C�� | 56g Fe���κ�������ȫ��Ӧʱת�Ƶĵ�����һ��Ϊ2NA | |
| D�� | 1molþ����������������Ӧ��ʧȥ2NA�ĵ��� |
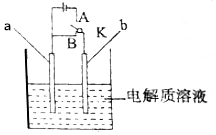 ����ͼ��ʾװ�ý���ʵ�飬��ش��������⣺
����ͼ��ʾװ�ý���ʵ�飬��ش��������⣺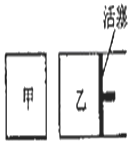 ���ݻ���ͬ�ļס������������У���ͼ��ʾ�����ֱ����2molSO2��2molO2��ʹ��������ͬ�¶��·�����Ӧ2SO2��g��+O2��g��?2S03��g�����ﵽƽ�⣮�ڷ�Ӧ�����У������������ݻ����䣬��������ѹǿ���䣬����S02��ת����Ϊb%����������SO2��ת����Ϊa%����a��b�Ĺ�ϵΪ��������
���ݻ���ͬ�ļס������������У���ͼ��ʾ�����ֱ����2molSO2��2molO2��ʹ��������ͬ�¶��·�����Ӧ2SO2��g��+O2��g��?2S03��g�����ﵽƽ�⣮�ڷ�Ӧ�����У������������ݻ����䣬��������ѹǿ���䣬����S02��ת����Ϊb%����������SO2��ת����Ϊa%����a��b�Ĺ�ϵΪ��������