题目内容
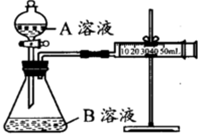 甲、乙两个实验小组分别利用KMnO4酸性溶液与H2C2O4溶液反应进行研究外界因素对反应速率的影响.设计实验方案如下:
甲、乙两个实验小组分别利用KMnO4酸性溶液与H2C2O4溶液反应进行研究外界因素对反应速率的影响.设计实验方案如下:甲组:通过测定生成CO2气体体积的方法来比较化学反应速率的大小.
实验装置如图,实验时分液漏斗中A溶液一次性放入B溶液中.
(注:实验中所用KMnO4溶液均已加人相同量H2SO4):
| 序号 | A溶液 | B溶液 |
| ① | 2mL 0.1mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
| ② | 2mL 0.2mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
(2)写出当锥形瓶中加入A溶液后发生的反应的离子方程式(提示:H2C2O4为弱酸):
(3)该实验探究的是
乙组:通过测定单位时间内KMnO4溶液浓度变化来判定反应速率快慢.25℃时,40mL 0.001mol/L KMnO4与38mL 0.1mol/L H2C2O4和2mL 2.38mol/L H2SO4混合液共80mL中KMnO4的浓度及对应时段的平均反应速率数据:
| 时间(min) | 4 | 8 | 12 | 16 | 21 | 22 | 23 | 24 | 25 |
| c(KMnO4)(10-4mol/L) | 4.58 | 4.02 | 3.36 | 2.25 | 0.72 | 0.43 | 0.23 | 0.16 | 0.13 |
| υ(KMnO4)(10-4mol/(L?min) | υ | 0.14 | 0.17 | 0.28 | 0.32 | 0.29 | 0.20 | 0.07 | 0.03 |
问题讨论:已知该实验过程中溶液温度几乎不变,但是依据实验数据发现开始阶段速率却在增大.
①你认为引起该反应速率增大的因素是
②请设计实验证明你的观点,写出实验步骤及结论:
| 实验步骤及结论: |
考点:探究温度、压强对化学反应速率的影响,化学反应速率的影响因素
专题:实验设计题
分析:本题以课本实验为基础,探究影响化学反应速率的因素,首先应该联系课本知识,了解影响化学反应速率的因素有哪些以及氧化还原知识,实验基本操作等基础知识,然后运用恰当的方法进行解题.
(1)使装置内外形成气压差是气密性检查的常用手段;
(2)高锰酸钾具有强氧化性,能把草酸氧化成二氧化碳,自身被还原成二价锰离子;
(3)从改变的条件看,H2C2O4浓度从0.1到0.2mol/L,故为浓度对化学反应速率的影响;
判断反应速率需要时间,用秒表计时;
比较在该环境中,相同时间收集到的气体体积,多的反应速率快;
(4)根据反应速率v=
计算速率的大小;
①溶液温度几乎不变,从数据看出反应的速率先增大后减小,可判断是催化剂的影响;
②选取两份相同的溶液,一份加入含有二价锰离子的物质,看能否加快反应速率.
(1)使装置内外形成气压差是气密性检查的常用手段;
(2)高锰酸钾具有强氧化性,能把草酸氧化成二氧化碳,自身被还原成二价锰离子;
(3)从改变的条件看,H2C2O4浓度从0.1到0.2mol/L,故为浓度对化学反应速率的影响;
判断反应速率需要时间,用秒表计时;
比较在该环境中,相同时间收集到的气体体积,多的反应速率快;
(4)根据反应速率v=
| △c |
| △t |
①溶液温度几乎不变,从数据看出反应的速率先增大后减小,可判断是催化剂的影响;
②选取两份相同的溶液,一份加入含有二价锰离子的物质,看能否加快反应速率.
解答:
解:(1)使装置内外形成气压差是气密性检查的常用手段,检查该装置的气密性可关闭分液漏斗活塞,向外拉注射器的内管一段距离后松手,若内管能回到开始位置,证明气密性好,若不能则说明气密性不好;
故答案为:关闭分液漏斗活塞,向外拉注射器的内管一段距离后松手,若内管能回到开始位置,证明气密性好,若不能则说明气密性不好;
(2)高锰酸钾具有强氧化性,把草酸中的C从+3价氧化成+4价的二氧化碳,Mn元素从+7价变化到+2价的锰离子,由于草酸分子中有2个C原子,所以高锰酸钾与草酸的反应比例为 5:2,故反应的方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++l0CO2↑+8H2O;
(3)从改变的条件看,H2C2O4浓度从0.1到0.2mol/L,故为浓度对化学反应速率的影响;
判断反应速率v=
,需要测定时间,可用秒表计时;
比较反应速率大小可比较在该环境中,相同时间收集到的气体体积,多的反应速率快,或者比较在该环境中,比较收集相同体积气体所用时间,越短速率越快;
故答案为:浓度;秒表;比较在该环境中,相同时间收集到的气体体积,多的反应速率快(或比较在该环境中,比较收集相同体积气体所用时间,越短速率越快);
(4)反应速率v=
=
=0.11×10-4mol/(L?min),故答案为:0.11;
①溶液温度几乎不变,从数据看出反应的速率先增大后减小,可判断是催化剂的影响,故答案为:反应过程中产生了催化剂加快了反应速率;
②选取两份相同的溶液,一份加入含有二价锰离子的物质,看能否加快反应速率,可设计实验为:
,故答案为:
.
故答案为:关闭分液漏斗活塞,向外拉注射器的内管一段距离后松手,若内管能回到开始位置,证明气密性好,若不能则说明气密性不好;
(2)高锰酸钾具有强氧化性,把草酸中的C从+3价氧化成+4价的二氧化碳,Mn元素从+7价变化到+2价的锰离子,由于草酸分子中有2个C原子,所以高锰酸钾与草酸的反应比例为 5:2,故反应的方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++l0CO2↑+8H2O;
(3)从改变的条件看,H2C2O4浓度从0.1到0.2mol/L,故为浓度对化学反应速率的影响;
判断反应速率v=
| △c |
| △t |
比较反应速率大小可比较在该环境中,相同时间收集到的气体体积,多的反应速率快,或者比较在该环境中,比较收集相同体积气体所用时间,越短速率越快;
故答案为:浓度;秒表;比较在该环境中,相同时间收集到的气体体积,多的反应速率快(或比较在该环境中,比较收集相同体积气体所用时间,越短速率越快);
(4)反应速率v=
| △c |
| △t |
| ||
| 4min |
①溶液温度几乎不变,从数据看出反应的速率先增大后减小,可判断是催化剂的影响,故答案为:反应过程中产生了催化剂加快了反应速率;
②选取两份相同的溶液,一份加入含有二价锰离子的物质,看能否加快反应速率,可设计实验为:
| 实验步骤及结论: 实验步骤:首先,取两支试管分别加入等体积上述酸性KMnO4溶液;接下来,向其中一支试管中加入少许MnSO4固体;最后,同时分别向两支试管中加入等体积的上述H2C2O4溶液,观察两支试管中颜色褪去的时间长短. 结论:若加有MnSO4固体试管褪色时间短,则证明是生成的Mn2+作催化剂. |
| 实验步骤及结论: 实验步骤:首先,取两支试管分别加入等体积上述酸性KMnO4溶液;接下来,向其中一支试管中加入少许MnSO4固体;最后,同时分别向两支试管中加入等体积的上述H2C2O4溶液,观察两支试管中颜色褪去的时间长短. 结论:若加有MnSO4固体试管褪色时间短,则证明是生成的Mn2+作催化剂. |
点评:本题以探究实验为基础,考查影响化学反应速率的因素、化学实验基本操作、氧化还原反应基础知识等,试题侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
将10.6g由Mg、Al、Si组成的合金投入足量的NaOH溶液中,在标准状况下产生气体11.2L;另取等质量的合金溶于过量稀H2SO4中,合金质量减少了7.8g.则合金中Mg、Al、Si的物质的量之比为( )
| A、1:2:1 |
| B、2:1:1 |
| C、1:3:2 |
| D、1:1:2 |
 2006年6月5日是第35个世界环境日,我国环保总局确定的主题见图.下列措施不符合这一主题的是( )
2006年6月5日是第35个世界环境日,我国环保总局确定的主题见图.下列措施不符合这一主题的是( )| A、用“绿色化学”工艺,使原料尽可能转化为所需的物质 |
| B、回收废电池,减少对环境的污染 |
| C、为使农作物高产,大量施用化肥和农药 |
| D、推广垃圾分类存放,分类回收,分类处理 |
一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合如图的是( )


| A、2C6H5CH2CH3(g)+O2(g)?2C6H5CH=CH2(g)+2H2O(g)△H<0 |
| B、CO2(g)+H2(g)?CO(g)+H2O(g)△H>0 |
| C、CH3CH2OH(g)?CH2=CH2(g)+H2O(g)△H>0 |
| D、CO2(g)+2NH3(g)?CO(NH2)2(s)+H2O(g)△H<0 |
取一定质量的CO和CO2的混合气体,通入足量Ba(OH)2溶液中,充分反应后过滤,发现生成的沉淀和所取的混合气体质量相等,则混合气体中,碳原子与氧原子的物质的量之比为( )
| A、181:209 | B、28:44 |
| C、1:2 | D、1:1 |
下列叙述正确的是( )
| A、往待测液中滴加氯水,然后滴加KSCN溶液,以检测待测液中是否含有Fe2+ |
| B、往待测液中滴加BaCl2,然后滴加盐酸,以检测待测液中是否含有SO42- |
| C、蒸馏操作时应将温度计的水银球插入液面下 |
| D、向试管中加入5mL SO2水溶液,然后滴加BaCl2溶液,再滴加3%的H2O2溶液,以检测SO2具有还原性 |
温室效应与下列气体无关的是( )
| A、二氧化碳 | B、二氧化硫 |
| C、水蒸气 | D、甲烷 |
已知在常温下溶液中的pH+pOH=14,又知正常人的血液的pH=7.3.则正常人血液的pOH是( )
| A、大于6.7 | B、小于6.7 |
| C、等于6.7 | D、无法判断 |