题目内容
已知在常温下溶液中的pH+pOH=14,又知正常人的血液的pH=7.3.则正常人血液的pOH是( )
| A、大于6.7 | B、小于6.7 |
| C、等于6.7 | D、无法判断 |
考点:pH的简单计算
专题:电离平衡与溶液的pH专题
分析:化学上的“常温”指25℃,常温下水的离子积为1×10-14,人的体温是37℃,略高于“常温”,水的电离电离吸热,所以电离出的氢离子、氢氧根离子浓度大,KW大,pH+pOH<14,所以pH小于14-7.3=6.7,据此分析解答.
解答:
解:水的离子积KW=c(H+)?c(OH-),化学上的“常温”指25℃,在常温下溶液中的pH+pOH=14,水的离子积为KW=1×10-14,c(H+)=1×10-7mol/L,
人的体温是37℃,水的电离吸热,电离出的氢离子、氢氧根离子浓度大,KW=c(H+)?c(OH-)>1×10-14,pH+pOH<14,pH=7.3的溶液POH<14-7.3<6.7,
故选B.
人的体温是37℃,水的电离吸热,电离出的氢离子、氢氧根离子浓度大,KW=c(H+)?c(OH-)>1×10-14,pH+pOH<14,pH=7.3的溶液POH<14-7.3<6.7,
故选B.
点评:本题考查了pH、pOH的关系,注意人的体温是37℃,略高于“常温”,水的电离吸热是解答本题的关键,易错选C,题目难度不大.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目
现代家庭室内装潢日益受到人们的推崇,由此引起的室内空气污染也成为人们关注的焦点,其中由装潢材料和家具的粘合剂等挥发出的甲醛是造成室内空气污染的主要污染物,根据甲醛的性质,下列做法正确的是( )
| A、装修完接着就入住 |
| B、装修尽可能选择在温度较低的冬季进行,以减少甲醛的挥发 |
| C、尽可能选择绿色环保的装饰材料进行装修 |
| D、通风后甲醛可以释放完全 |
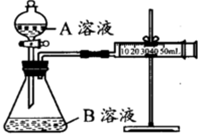 甲、乙两个实验小组分别利用KMnO4酸性溶液与H2C2O4溶液反应进行研究外界因素对反应速率的影响.设计实验方案如下:
甲、乙两个实验小组分别利用KMnO4酸性溶液与H2C2O4溶液反应进行研究外界因素对反应速率的影响.设计实验方案如下: 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
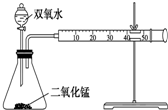 某化学实验小组为确定过氧化氢分解的最佳催化条件,用如图装置进行实验,反应物用量和反应停止的时间数据如下表:
某化学实验小组为确定过氧化氢分解的最佳催化条件,用如图装置进行实验,反应物用量和反应停止的时间数据如下表: