题目内容
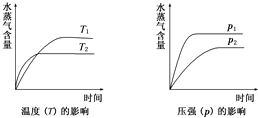
一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合如图的是( )

| A、2C6H5CH2CH3(g)+O2(g)?2C6H5CH=CH2(g)+2H2O(g)△H<0 |
| B、CO2(g)+H2(g)?CO(g)+H2O(g)△H>0 |
| C、CH3CH2OH(g)?CH2=CH2(g)+H2O(g)△H>0 |
| D、CO2(g)+2NH3(g)?CO(NH2)2(s)+H2O(g)△H<0 |
考点:体积百分含量随温度、压强变化曲线
专题:化学平衡专题
分析:根据先拐先平可知,T1<T2,P1>P2,据图可知,随温度的升高,水的含量下降,随着压强增大,水的含量增大,据此答题.
解答:
解:由先拐先平可知,T1<T2,P1>P2,据图可知,随温度的升高,水的含量下降,随着压强增大,水的含量增大,
A、因为该反应为气体体积增大的放热反应,所以增大压强,水的含量减小,故A错误;
B、因为该反应为气体体积不变的吸热反应,所以增大压强,水的含量不变,升高温度,水的含量增大,故B错误;
C、因为该反应为气体体积增大的吸热反应,所以增大压强,水的含量减小,升高温度,水的含量增大,故C错误;
D、因为该反应为气体体积减小的放热反应,所以增大压强,水的含量增大,升高温度,水的含量减小,故D正确;
故选D.
A、因为该反应为气体体积增大的放热反应,所以增大压强,水的含量减小,故A错误;
B、因为该反应为气体体积不变的吸热反应,所以增大压强,水的含量不变,升高温度,水的含量增大,故B错误;
C、因为该反应为气体体积增大的吸热反应,所以增大压强,水的含量减小,升高温度,水的含量增大,故C错误;
D、因为该反应为气体体积减小的放热反应,所以增大压强,水的含量增大,升高温度,水的含量减小,故D正确;
故选D.
点评:本题主要考查了根据图象判断外界条件对平衡移动的影响,并据此找出符合条件的化学方程式,难度不大,解题时要抓住先拐先平的特征.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列关于水体污染及防治的说法正确的是( )
| A、N和P是植物营养素,海洋或湖泊中N、P含量越高越有利于水生动植物的生长 |
| B、只要不喝被重金属污染的水就不会中毒,因此水中的重金属污染对人类影响不大 |
| C、用熟石灰处理钢铁厂的酸性废水,利用的是复分解反应原理 |
| D、用Na2S处理含Hg2+废水使Hg2+变成HgS沉淀而除去,利用的是氧化还原反应原理 |
一定条件下,将NO2与SO2以2:3的体积比置于密闭容器中发生上反应:NO2(g)+SO2(g)?SO3(g)+NO(g),测得上述反应平衡时NO2与SO2体积比为1:4,则平衡时SO2(g)的转化率是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
下列做法中,不利于实现让定州“天更蓝,水更清”目标的是( )
| A、推广使用无磷洗涤剂 |
| B、推广使用脱硫煤 |
| C、减少汽车尾气排放 |
| D、任意排放污水 |
 甲、乙两个实验小组分别利用KMnO4酸性溶液与H2C2O4溶液反应进行研究外界因素对反应速率的影响.设计实验方案如下:
甲、乙两个实验小组分别利用KMnO4酸性溶液与H2C2O4溶液反应进行研究外界因素对反应速率的影响.设计实验方案如下: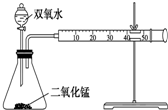 某化学实验小组为确定过氧化氢分解的最佳催化条件,用如图装置进行实验,反应物用量和反应停止的时间数据如下表:
某化学实验小组为确定过氧化氢分解的最佳催化条件,用如图装置进行实验,反应物用量和反应停止的时间数据如下表: