题目内容
某有机物M的结构简式如图,下列叙述错误的是( )
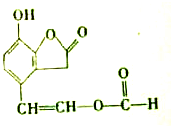

| A、M的分子式为C11H8O4 |
| B、M能发生银镜反应 |
| C、M能使FeCl3溶液呈紫色 |
| D、1mol M与足量NaOH溶液反应时,最多消耗3mol NaOH |
考点:有机物的结构和性质
专题:
分析:由结构简式可知,分子中含酚-OH、-COOC-、双键及-CHO,结合酚、烯烃、酯、醛的性质来解答.
解答:
解:A.M的分子式为C11H8O5,故A错误;
B.含-CHO,能发生银镜反应,故B正确;
C.M中含酚-OH,能使FeCl3溶液呈紫色,故C正确;
D.含酚-OH、-COOC-、-COOCH,且-COOC-水解生成的酚-OH也与NaOH反应,则1mol M与足量NaOH溶液反应时,最多消耗4mol NaOH,故D错误;
故选AD.
B.含-CHO,能发生银镜反应,故B正确;
C.M中含酚-OH,能使FeCl3溶液呈紫色,故C正确;
D.含酚-OH、-COOC-、-COOCH,且-COOC-水解生成的酚-OH也与NaOH反应,则1mol M与足量NaOH溶液反应时,最多消耗4mol NaOH,故D错误;
故选AD.
点评:本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重酚、烯烃、酯、醛性质的考查,题目难度不大.

练习册系列答案
相关题目
“物质的量”是指( )
| A、物质的质量 |
| B、物质的微观粒子数 |
| C、物质的质量与微观粒子数 |
| D、能把物质的质量同微观粒子数联系起来的一个基本物理量 |
如图是侯氏制碱法在实验室进行模拟实验的生产流程示意图,则下列叙述正确的是( )
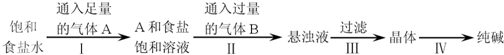

| A、A气体是CO2,B气体是NH3 |
| B、第Ⅲ步得到的晶体是Na2CO3?10H2O |
| C、第Ⅱ步的离子方程式为Na++NH3?H2O+CO2═NaHCO3↓+NH4+ |
| D、第Ⅳ步操作的主要过程有溶解、蒸发、结晶 |
 某研究性学习小组对铝热反应实验展开研究.现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
某研究性学习小组对铝热反应实验展开研究.现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下: