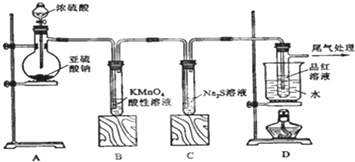
题目内容
如图是侯氏制碱法在实验室进行模拟实验的生产流程示意图,则下列叙述正确的是( )
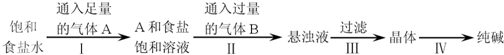

| A、A气体是CO2,B气体是NH3 |
| B、第Ⅲ步得到的晶体是Na2CO3?10H2O |
| C、第Ⅱ步的离子方程式为Na++NH3?H2O+CO2═NaHCO3↓+NH4+ |
| D、第Ⅳ步操作的主要过程有溶解、蒸发、结晶 |
考点:纯碱工业(侯氏制碱法)
专题:元素及其化合物
分析:A.依据侯德榜制碱的原理:向氨化的饱和食盐水中通入足量二氧化碳气体析出碳酸氢钠,加热分解碳酸氢钠来制备碳酸钠;
B.第Ⅲ步得到的晶体是碳酸氢钠;
C.第Ⅱ步发生反应NH3?H2O+CO2+NaCl═NH4Cl+NaHCO3↓,据此分析;
D.第Ⅳ步操作是将晶体碳酸氢钠直接加热分解得到碳酸钠固体.
B.第Ⅲ步得到的晶体是碳酸氢钠;
C.第Ⅱ步发生反应NH3?H2O+CO2+NaCl═NH4Cl+NaHCO3↓,据此分析;
D.第Ⅳ步操作是将晶体碳酸氢钠直接加热分解得到碳酸钠固体.
解答:
解:A.氨气极易溶于水,二氧化碳在水中的溶解度较小,依据侯德榜制碱的原理:向氨化的饱和食盐水中通入二氧化碳气体析出碳酸氢钠,加热反应制备,A为氨气,B为二氧化碳,故A错误;
B.第Ⅱ步反应方程式为NH3?H2O+CO2+NaCl═NH4Cl+NaHCO3↓,过滤是把不溶于溶液的固体和液体分开的一种分离混合物的方法,从沉淀池中分离沉淀NaHCO3晶体,所以第Ⅲ步得到的晶体是NaHCO3,故B错误;
C.第Ⅱ步发生反应NH3?H2O+CO2+NaCl═NH4Cl+NaHCO3↓,一水合氨为弱碱,碳酸氢钠为沉淀,所以离子反应为Na++NH3?H2O+CO2═NaHCO3↓+NH4+,故C正确;
D.第Ⅳ步操作是将晶体碳酸氢钠直接加热分解得到碳酸钠固体,发生反应2NaHCO3
Na2CO3+H2O+CO2↑,故D错误;
故选C.
B.第Ⅱ步反应方程式为NH3?H2O+CO2+NaCl═NH4Cl+NaHCO3↓,过滤是把不溶于溶液的固体和液体分开的一种分离混合物的方法,从沉淀池中分离沉淀NaHCO3晶体,所以第Ⅲ步得到的晶体是NaHCO3,故B错误;
C.第Ⅱ步发生反应NH3?H2O+CO2+NaCl═NH4Cl+NaHCO3↓,一水合氨为弱碱,碳酸氢钠为沉淀,所以离子反应为Na++NH3?H2O+CO2═NaHCO3↓+NH4+,故C正确;
D.第Ⅳ步操作是将晶体碳酸氢钠直接加热分解得到碳酸钠固体,发生反应2NaHCO3
| ||
故选C.
点评:本题考查了侯德榜制碱的工作原理和流程分析,明确碳酸钠、碳酸氢钠、氨气、二氧化碳的性质,掌握工艺流程和反应原理是解题关键,题目难度中等.

练习册系列答案
相关题目
以下是一些常用的危险品标志,如图所列物质与危险警告标志对应错误的是( )
A、 氯气 |
B、 四氯化碳 |
C、 氢氧化钠 |
D、 KNO3 KNO3 |
某有机物M的结构简式如图,下列叙述错误的是( )
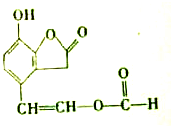

| A、M的分子式为C11H8O4 |
| B、M能发生银镜反应 |
| C、M能使FeCl3溶液呈紫色 |
| D、1mol M与足量NaOH溶液反应时,最多消耗3mol NaOH |
根据表数据,下列判断正确的是( )
| 电离常数(25℃) |
| HF: Ka1=3.6×10-4 |
| H3PO4: Ka1=7.5×10-3 Ka2=6.2×10-8 Ka3=2.2×10-13 |
| A、在等浓度的NaF、NaH2PO4混合溶液中,c(Na+)+c(H+)=c(F-)+c(H2PO4-)+c(OH-) |
| B、少量H3PO4和NaF反应的离子方程式为:H3PO4+F-→H2PO4-+HF |
| C、同温同浓度时,溶液的pH:NaF>NaH2PO4>Na2HPO4 |
| D、结合H+的能力:PO43->F->HPO42- |
从柑橘中提取得到结构简式如下图所示的化合物,则下列有关它的推断错误的是( )
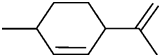

| A、分子式为C10H16 |
| B、常温下呈固态,比水重 |
| C、其一氯代物有8种 |
| D、能与溴水发生加成反应 |