题目内容
某学生用12mol/L的盐酸配制0.1mol/L的稀盐酸500ml.回答下列问题:
(1)量取浓盐酸的体积 mL.应选用的量筒规格为 mL(该空填“10”或“50”).
(2)配制时选用的容量瓶规格为 mL.
(3)配制时(除容量瓶)还需选用的主要玻璃仪器为 、 、 等.
(1)量取浓盐酸的体积
(2)配制时选用的容量瓶规格为
(3)配制时(除容量瓶)还需选用的主要玻璃仪器为
考点:溶液的配制
专题:化学实验基本操作
分析:设量取浓盐酸的体积是V.根据稀释前后HCl物质的量守恒建立关系式求得浓盐酸的体积;根据稀盐酸的体积来选取容量瓶的规格;结合配置步骤选取仪器.
解答:
解:(1)设量取浓盐酸的体积是V.根据题意,得12mol/LV=0.10mol/L×0.5L,解得V=4.2(mL),
由于没有此种规格的容量瓶,所以用10mL的容量瓶;
故答案为:4.2;10mL;
(2)因为要制取500mL稀盐酸,所以选用500mL的容量瓶;故答案为:500mL;
(3)配置一定质量分数的溶液,一般要经过计算、量取(使用量筒量取、胶头滴管)、稀释(在烧杯中稀释、玻璃棒搅拌均匀)、转移到容量瓶中定容;
故答案为:烧杯;玻璃棒;胶头滴管.
由于没有此种规格的容量瓶,所以用10mL的容量瓶;
故答案为:4.2;10mL;
(2)因为要制取500mL稀盐酸,所以选用500mL的容量瓶;故答案为:500mL;
(3)配置一定质量分数的溶液,一般要经过计算、量取(使用量筒量取、胶头滴管)、稀释(在烧杯中稀释、玻璃棒搅拌均匀)、转移到容量瓶中定容;
故答案为:烧杯;玻璃棒;胶头滴管.
点评:本题主要考查了一定质量分数的溶液的配置、有关溶质质量分数的简单计算.配制一定质量分数的溶液,是考查的热点.操作步骤、实验仪器、配制方案的设计、实验过程中的误差分析,都将是考查的重点.

练习册系列答案
相关题目
某有机物M的结构简式如图,下列叙述错误的是( )
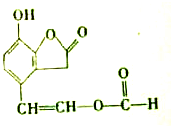

| A、M的分子式为C11H8O4 |
| B、M能发生银镜反应 |
| C、M能使FeCl3溶液呈紫色 |
| D、1mol M与足量NaOH溶液反应时,最多消耗3mol NaOH |
下列关于乙烯的说法中错误的是( )
| A、乙烯可以催熟植物的果实 |
| B、乙烯可以与水发生加成反应 |
| C、乙烯分子的空间构型是正四面体 |
| D、使用溴水或KMnO4 溶液,都可以鉴别乙烯和乙烷 |
从柑橘中提取得到结构简式如下图所示的化合物,则下列有关它的推断错误的是( )
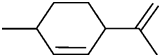

| A、分子式为C10H16 |
| B、常温下呈固态,比水重 |
| C、其一氯代物有8种 |
| D、能与溴水发生加成反应 |
以铁为阳极、以铜为阴极,对足量的NaOH溶液进行电解.一段时间后得到2molFe(OH)3沉淀,此时共消耗的水的物质的量为( )
| A、2 mol |
| B、3 mol |
| C、4 mol |
| D、5 mol |
 为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验.
为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验.
