题目内容
五种短周期元素A、B、C、D、E,原子序数逐渐增大,A、B处于同一周期,C、D、E同处另一周期.C、B可按原子个数比2:l和1:1分别形成两种离子化合物甲和乙.A原子的最外层电子数比次外层电子层多3个.E周期序数等于E原子最外层电子数.根据以上信息回答下列问题:
(1)A、B、C、D、E五种元素的原子半径由小到大的顺序是 (用元素符号填写).
(2)乙物质中存在的化学键类型是 .
(3)选用恰当的试剂除去D中少量的E,写出发生反应的化学方程式 .
(4)化合物乙的电子式 .
(5)将D、E的单质插入NaOH溶液中,构成原电池,其负极反应是 .
(1)A、B、C、D、E五种元素的原子半径由小到大的顺序是
(2)乙物质中存在的化学键类型是
(3)选用恰当的试剂除去D中少量的E,写出发生反应的化学方程式
(4)化合物乙的电子式
(5)将D、E的单质插入NaOH溶液中,构成原电池,其负极反应是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E都是短周期元素,原子序数逐渐增大,A、B处于同一周期,C、D、E同处另一周期,C、B可按原子个数比2:l和1:1分别形成两种离子化合物甲和乙,则C是Na元素,B是O元素,甲是氧化钠,乙是过氧化钠,A原子的最外层电子数比次外层电子层多3个且位于第二周期,A元素的第二电子层为5个电子第一电子层为2个电子,则A是N元素,D位于第三周期且原子序数大于钠而小于铝,则D是Mg元素,E周期序数等于E原子最外层电子数,且原子序数比镁大,则E是第三周期,第ⅢA族元素,即为Al元素,据此答题;
解答:
解:A、B、C、D、E都是短周期元素,原子序数逐渐增大,A、B处于同一周期,C、D、E同处另一周期,C、B可按原子个数比2:l和1:1分别形成两种离子化合物甲和乙,则C是Na元素,B是O元素,甲是氧化钠,乙是过氧化钠,A原子的最外层电子数比次外层电子层多3个且位于第二周期,A元素的第二电子层为5个电子第一电子层为2个电子,则A是N元素,D位于第三周期且原子序数大于钠而小于铝,则D是Mg元素,E周期序数等于E原子最外层电子数,且原子序数比镁大,则E是第三周期,第ⅢA族元素,即为Al元素,
(1)原子的电子层数越多,其原子半径越大,同一周期元素中,原子半径随着原子序数的增大而减小,所以这几种元素的原子半径从小到大顺序是:O<N<Al<Mg<Na,故答案为:O<N<Al<Mg<Na;
(2)乙是过氧化钠,过氧化钠中钠离子和过氧根离子之间存在离子键,氧原子和氧原子之间存在共价键,故答案为:离子键、共价键;
(3)D为Mg,E为Al,镁不和氢氧化钠溶液反应,铝和氢氧化钠溶液反应,所以可以用氢氧化钠溶液除去镁中的铝,反应方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(4)化合物是过氧化钠,它的电子式为 ,故答案为:
,故答案为: ;
;
(5)镁、铝和氢氧化钠溶液构成的原电池中,铝易失电子发生氧化反应而作负极,镁作正极,其负极反应是Al-3e-+4OH-=AlO2-+2H2O,故答案为:Al-3e-+4OH-=AlO2-+2H2O;
(1)原子的电子层数越多,其原子半径越大,同一周期元素中,原子半径随着原子序数的增大而减小,所以这几种元素的原子半径从小到大顺序是:O<N<Al<Mg<Na,故答案为:O<N<Al<Mg<Na;
(2)乙是过氧化钠,过氧化钠中钠离子和过氧根离子之间存在离子键,氧原子和氧原子之间存在共价键,故答案为:离子键、共价键;
(3)D为Mg,E为Al,镁不和氢氧化钠溶液反应,铝和氢氧化钠溶液反应,所以可以用氢氧化钠溶液除去镁中的铝,反应方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(4)化合物是过氧化钠,它的电子式为
 ,故答案为:
,故答案为: ;
;(5)镁、铝和氢氧化钠溶液构成的原电池中,铝易失电子发生氧化反应而作负极,镁作正极,其负极反应是Al-3e-+4OH-=AlO2-+2H2O,故答案为:Al-3e-+4OH-=AlO2-+2H2O;
点评:本题考查了物质结构和性质,涉及原电池原理、除杂、元素周期律等知识点,这些都是学习重点,根据原子结构及元素周期表正确判断元素是解本题关键,注意(5)中不能根据金属的活泼性判断正负极,要根据得失电子的难易程度判断正负极,为易错点.

练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目
下列有关化学键的叙述,正确的是( )
| A、离子化合物中不一定含有离子键 |
| B、单质分子中均不存在化学键 |
| C、由C元素形成的单质不一定是原子晶体 |
| D、含有共价键的化合物一定是共价化合物 |
下列分散系不能发生丁达尔现象的是( )
| A、酒精溶液 | B、牛奶 |
| C、豆浆 | D、烟、云、雾 |
短周期主族元素X、Y、Z、W,原子序数依次增大.X、Z同主族,X、Y、Z三种元素主族序数之和为15,Y原子最外层电子数等于X原子最外层电子数的一半.下列叙述正确的是( )
| A、非金属性:X<Z |
| B、原子半径:X<W<Z<Y |
| C、最高价氧化物对应水化物的酸性:W<Z |
| D、单质Y常温下能溶于浓硝酸 |
某有机物M的结构简式如图,下列叙述错误的是( )
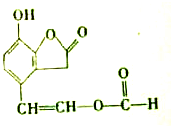

| A、M的分子式为C11H8O4 |
| B、M能发生银镜反应 |
| C、M能使FeCl3溶液呈紫色 |
| D、1mol M与足量NaOH溶液反应时,最多消耗3mol NaOH |