题目内容
在酸性溶液中,碘酸钾(KIO3)和Na2SO3可发生如下反应:2IO3-+5SO32-+2H+=═I2+5SO42-+H2O,生成的碘可以用淀粉溶液检验,根据溶液出现蓝色所需的时间来衡量该反应的速率.某学生设计实验如下表所示:
(1)该反应的氧化剂是 ,若生成1mol I2,转移电子的物质的量是 .
(2)V1= mL,V2= mL.
(3)如果研究浓度对反应速率的影响,使用实验 和实验 .
(4)对比实验1和实验2,可以研究 对化学反应速率的影响.
(5)溶液出现蓝色所需的时间从多到少的顺序是 (用a、b、c表示).
| 0.01mol/L KIO3溶液的体积/mL | Na2SO3溶液的体积/mL | H2O的体积/mL | 实验温度/℃ | 溶液出现蓝色所需的时间 | |
| 实验1 | 5 | 5 | V1 | 0 | a |
| 实验2 | 5 | 5 | 40 | 25 | b |
| 实验3 | 5 | V2 | 35 | 25 | c |
(2)V1=
(3)如果研究浓度对反应速率的影响,使用实验
(4)对比实验1和实验2,可以研究
(5)溶液出现蓝色所需的时间从多到少的顺序是
考点:测定某些化学反应的速率,氧化还原反应
专题:化学反应速率专题
分析:(1)氧化还原反应中,化合价降低的元素所在的反应物是氧化剂,化合价降低数值=化合价升高值=转移电子数,据此回答判断;
(2)表中数据判断实验目的,由实验2可以看出混合液的总体积为50mL,V1为40mL,V2为15mL;
(3)实验2和实验3可知,温度相等,实验目的是探究该反应速率与浓度的关系;
(4)实验1和实验2可知,浓度相等,实验目的是探究该反应速率与温度的关系;
(5)温度越高,反应速率越快,浓度越大,反应速率越快,据此回答.
(2)表中数据判断实验目的,由实验2可以看出混合液的总体积为50mL,V1为40mL,V2为15mL;
(3)实验2和实验3可知,温度相等,实验目的是探究该反应速率与浓度的关系;
(4)实验1和实验2可知,浓度相等,实验目的是探究该反应速率与温度的关系;
(5)温度越高,反应速率越快,浓度越大,反应速率越快,据此回答.
解答:
解:(1)氧化还原反应中,化合价降低的I元素所在的反应物KIO3是氧化剂,化合价降低数值=化合价升高值=转移电子数=10mol,故答案为:KIO3;10mol;
(2)表中数据判断实验目的,由实验2可以看出混合液的总体积为50mL,V1为40mL,V2为15mL,故答案为:40;15;
(3)探究该反应速率与浓度的关系,需要控制温度相等,所以实验2和实验3能达到目的,故答案为:2;3;
(4)实验1和实验2可知,浓度相等,实验目的是探究该反应速率与温度的关系,故答案为:温度;
(5)实验3温度最高,浓度最大,所以速率最快,蓝色出现时间最短,实验2比实验1的温度高,所以反应速率快,出现蓝色用的时间比1的短,故答案为:abc.
(2)表中数据判断实验目的,由实验2可以看出混合液的总体积为50mL,V1为40mL,V2为15mL,故答案为:40;15;
(3)探究该反应速率与浓度的关系,需要控制温度相等,所以实验2和实验3能达到目的,故答案为:2;3;
(4)实验1和实验2可知,浓度相等,实验目的是探究该反应速率与温度的关系,故答案为:温度;
(5)实验3温度最高,浓度最大,所以速率最快,蓝色出现时间最短,实验2比实验1的温度高,所以反应速率快,出现蓝色用的时间比1的短,故答案为:abc.
点评:本题考查较综合,涉及氧化还原反应的概念、影响反应速率的因素等,注重高频考点的考查,综合性强,题目难度中等.

练习册系列答案
相关题目
下列分散系不能发生丁达尔现象的是( )
| A、酒精溶液 | B、牛奶 |
| C、豆浆 | D、烟、云、雾 |
某有机物M的结构简式如图,下列叙述错误的是( )
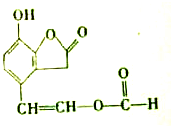

| A、M的分子式为C11H8O4 |
| B、M能发生银镜反应 |
| C、M能使FeCl3溶液呈紫色 |
| D、1mol M与足量NaOH溶液反应时,最多消耗3mol NaOH |
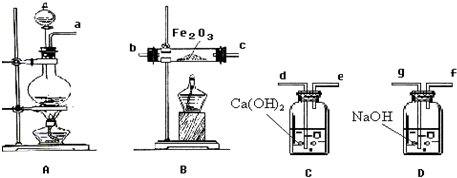


 为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验.
为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验.