题目内容
X、Y、Z、Q、M为常见的短周期元素,其原子序数依次增大.有关信息如下表:
(1)X的气态氢化物的大量生产曾经解决了地球上因粮食不足而导致的饥饿和死亡问题,请写出该气态氢化物的电子式 .
(2)已知37Rb和53I都位于第五周期,分别与Z和M同一主族.下列有关说法正确的是 (填序号).
A.原子半径:Rb>I B.RbM中含有共价键 C.气态氢化物热稳定性:M>I
D.Rb、Q、M的最高价氧化物对应的水化物可以两两发生反应
(3)工业上用电解熔融的Q的氧化物的方法制备金属Q、写出电解的化学方程式 .每生产0.324吨Q,理论上转移电子的物质的量为 mol.
(4)X、Y组成的一种无色气体遇空气变为红棕色.将标准状况下40L该无色气体与15L氧气通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成两种盐.请写出该反应的离子方程式 .
| X | 动植物生长不可缺少的元素,是蛋白质的重要成分 |
| Y | 地壳中含量居第一位 |
| Z | 短周期中其原子半径最大 |
| Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备 |
| M | 海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
(2)已知37Rb和53I都位于第五周期,分别与Z和M同一主族.下列有关说法正确的是
A.原子半径:Rb>I B.RbM中含有共价键 C.气态氢化物热稳定性:M>I
D.Rb、Q、M的最高价氧化物对应的水化物可以两两发生反应
(3)工业上用电解熔融的Q的氧化物的方法制备金属Q、写出电解的化学方程式
(4)X、Y组成的一种无色气体遇空气变为红棕色.将标准状况下40L该无色气体与15L氧气通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成两种盐.请写出该反应的离子方程式
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z、Q、M为常见的短周期元素,其原子序数依次增大,X是动植物生长不可缺少的元素,是蛋白质的重要成分,则X为氮元素;Y在地壳中含量居第一位,则Y为氧元素;短周期中Z的原子半径最大,则Z为Na;Q是生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备,则Q为Al;M是海水中大量富集的元素之一,其最高正化合价与负价的代数和为6,则M为Cl元素,据此解答.
解答:
解:X、Y、Z、Q、M为常见的短周期元素,其原子序数依次增大,X是动植物生长不可缺少的元素,是蛋白质的重要成分,则X为氮元素;Y在地壳中含量居第一位,则Y为氧元素;短周期中Z的原子半径最大,则Z为Na;Q是生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备,则Q为Al;M是海水中大量富集的元素之一,其最高正化合价与负价的代数和为6,则M为Cl元素,
(1)X的气态氢化物的大量生产曾经解决了地球上因粮食不足而导致的饥饿和死亡问题,该氢化物为NH3,其电子式为 ,
,
故答案为: ;
;
(2)A.同周期自左而右,主族元素的原子半径减小,故原子半径:Rb>I,故A正确;
B.RbCl含有离子键,没有共价键,故B错误;
C.同主族自上而下非金属性减弱,气态氢化物热稳定性减弱,故稳定性HCl>HI,故C正确;
D.Rb、Q、M的最高价氧化物对应的水化物分别为RrOH、氢氧化铝、高氯酸,RbOH是强碱、高氯酸是强酸,氢氧化铝是两性氢氧化物,溶于强碱、强酸,故D正确;
故答案为:ACD;
(3)工业上用电解熔融氧化铝的方程式为2Al2O3(熔融)
4Al+3O2↑;根据Al→3e-,每生产0.324吨Al,理论上转移电子的物质的量为
×3=3.6×104mol;
故答案为:2Al2O3(熔融)
4Al+3O2↑;3.6×104;
(4)X、Y组成的一种无色气体遇空气变为红棕色,则该气体为NO,.将标准状况下40LNO与15L氧气通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成两种盐,生成硝酸钠、亚硝酸钠,令硝酸钠、亚硝酸钠的物质的量分别为xmol、ymol,则:
,解得x:y=1:3,故反应离子方程式为:8NO+3O2+8OH-=2NO3-+6NO2-+4H2O,
故答案为:8NO+3O2+8OH-=2NO3-+6NO2-+4H2O.
(1)X的气态氢化物的大量生产曾经解决了地球上因粮食不足而导致的饥饿和死亡问题,该氢化物为NH3,其电子式为
 ,
,故答案为:
 ;
;(2)A.同周期自左而右,主族元素的原子半径减小,故原子半径:Rb>I,故A正确;
B.RbCl含有离子键,没有共价键,故B错误;
C.同主族自上而下非金属性减弱,气态氢化物热稳定性减弱,故稳定性HCl>HI,故C正确;
D.Rb、Q、M的最高价氧化物对应的水化物分别为RrOH、氢氧化铝、高氯酸,RbOH是强碱、高氯酸是强酸,氢氧化铝是两性氢氧化物,溶于强碱、强酸,故D正确;
故答案为:ACD;
(3)工业上用电解熔融氧化铝的方程式为2Al2O3(熔融)
| ||
| 冰晶石 |
| 324×103g |
| 27g/mol |
故答案为:2Al2O3(熔融)
| ||
| 冰晶石 |
(4)X、Y组成的一种无色气体遇空气变为红棕色,则该气体为NO,.将标准状况下40LNO与15L氧气通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成两种盐,生成硝酸钠、亚硝酸钠,令硝酸钠、亚硝酸钠的物质的量分别为xmol、ymol,则:
|
故答案为:8NO+3O2+8OH-=2NO3-+6NO2-+4H2O.
点评:本题考查结构性质位置关系应用,难度中等,(3)中关键是计算硝酸钠与亚硝酸钠的物质的量关系.

练习册系列答案
相关题目
某有机物M的结构简式如图,下列叙述错误的是( )
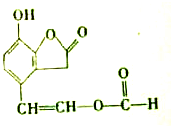

| A、M的分子式为C11H8O4 |
| B、M能发生银镜反应 |
| C、M能使FeCl3溶液呈紫色 |
| D、1mol M与足量NaOH溶液反应时,最多消耗3mol NaOH |
下列关于乙烯的说法中错误的是( )
| A、乙烯可以催熟植物的果实 |
| B、乙烯可以与水发生加成反应 |
| C、乙烯分子的空间构型是正四面体 |
| D、使用溴水或KMnO4 溶液,都可以鉴别乙烯和乙烷 |
以铁为阳极、以铜为阴极,对足量的NaOH溶液进行电解.一段时间后得到2molFe(OH)3沉淀,此时共消耗的水的物质的量为( )
| A、2 mol |
| B、3 mol |
| C、4 mol |
| D、5 mol |
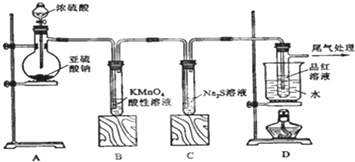


 为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验.
为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验.