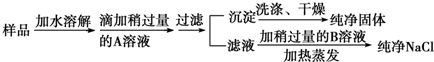
题目内容
15. 硒是人体必需的微量元素,它在元素周期表中的位置如图所示.
硒是人体必需的微量元素,它在元素周期表中的位置如图所示.| 磷 | 硫 | ||
| 砷 | 硒 |
a.+99.7kJ•mol-1 b.+29.7kJ•mol-1c.-20.6kJ•mol-1 d.-241.8kJ•mol-1
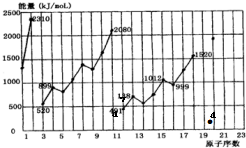
(2)不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如图所示.试根据元素在周期表中的位置,分析图中曲线的变化特点,并回答下列问题.
同周期内,随原子序数增大,E值增大.但个别元素的E值出现反常现象.试预测下列关系式中正确的是ac(填写编号,多选倒扣)
a、E(砷)>E(硒)
b、E(砷)<E(硒)
c、E(溴)>E(硒)
d、E(溴)<E(硒)
估计1mol气态Ca原子失去最外层一个电子所需能量E值的范围419<E<738.
分析 (1)Se的最高化合价为+6,结合硫酸的分子式书写最高价氧化物对应的水化物化学式;同主族自上而下非金属性减弱,单质与氢气反应剧烈程度减小,反应热增大(考虑符号);
(2)同一周期中,从左到右第一电离能逐渐增大,第ⅤA族最外层为半充满结构,较稳定,第一电离能较大.
解答 解:(1)Se与O元素同族元素,Se的最高化合价为+6,最高价氧化物对应的水化物化学式为H2SeO4,同主族自上而下非金属性减弱,单质与氢气反应剧烈程度减小,反应热增大(考虑符号),故生成1mol硒化氢(H2Se)反应热应排在第二位,应为+29.7kJ•mol-1,则热化学方程式为H2(g)+Se(s)═H2Se(g) H=+29.7kJ/mol,
故答案为:H2SeO4;H2(g)+Se(s)═H2Se(g) H=+29.7kJ/mol;
(2)同一周期中,从左到右第一电离能逐渐增大,第ⅤA族元素的E值大于第ⅥA族的小于第ⅥⅠA的,则ac正确;
同一周期,第ⅠA族的E值小于第ⅡA族的,所以钙的第一电离能大于419 KJ/mol,同一主族,E值随着原子序数的增大而减小,所以钙的第一电离能小于738 KJ/mol.
故答案为:ac;419<E<738.
点评 本题考查位置、结构、性质的相互关系及应用,题目难度不大,注意把握元素周期律的主要内容,注意电离能的大小与核外电子排布的关系.

练习册系列答案
相关题目
3.工业制H2SO4时,对SO2净化和干燥的目的是( )
①除尘,避免催化剂中毒;②洗涤,避免催化剂中毒;③干燥,避免催化剂中毒; ④干燥,避免设备腐蚀.
①除尘,避免催化剂中毒;②洗涤,避免催化剂中毒;③干燥,避免催化剂中毒; ④干燥,避免设备腐蚀.
| A. | ①②③ | B. | ①②④ | C. | ①④ | D. | ①②③④ |
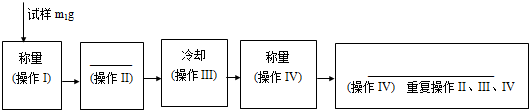
4.根据实验室测定硫酸铜晶体(CuSO4•5H2O)结晶水含量的实验,填写下列空白.
(1)除需要酒精灯、玻璃棒、坩埚钳、药匙、三脚架等仪器外,从下列仪器中选出所需仪器(用标号字母填写)ABDF.
A.电子天平 B.研钵 C.试管夹 D.坩埚 E.蒸发皿 F.干燥器 G.石棉网
还需要的仪器是泥三角.
(2)某学生实验后得到以下数据:
请写出结晶水x=4.81.本次实验的相对误差=-3.8%.
(3)该学生测定结果是偏高还是偏低?偏低.从下列选项中选出该学生产生误差的原因可能是(填写字母)BC.
A.加热前称量时容器未完全干燥 B.最后两次加热后的质量相差较大(大于0.001g)
C.加热后容器未放入干燥器中冷却 D.加热过程中晶体有少量溅失.
(4)测定硫酸铜晶体中结晶水的含量,至少在天平上进行四次称量,第三、四次称量的目的是进行恒重操作,判断达到恒重的依据是直到连续两次称量误差不得超过0.001g为止.
(1)除需要酒精灯、玻璃棒、坩埚钳、药匙、三脚架等仪器外,从下列仪器中选出所需仪器(用标号字母填写)ABDF.
A.电子天平 B.研钵 C.试管夹 D.坩埚 E.蒸发皿 F.干燥器 G.石棉网
还需要的仪器是泥三角.
(2)某学生实验后得到以下数据:
| 加热前的质量 | 加热后的质量 | ||
| W1(容器) | W2(容器+晶体) | W3(容器+无水硫酸铜) | |
| 第一次 | 15.688g | 17.668g | 16.962g |
| 第二次 | 15.688g | 17.744g | 17.033g |
(3)该学生测定结果是偏高还是偏低?偏低.从下列选项中选出该学生产生误差的原因可能是(填写字母)BC.
A.加热前称量时容器未完全干燥 B.最后两次加热后的质量相差较大(大于0.001g)
C.加热后容器未放入干燥器中冷却 D.加热过程中晶体有少量溅失.
(4)测定硫酸铜晶体中结晶水的含量,至少在天平上进行四次称量,第三、四次称量的目的是进行恒重操作,判断达到恒重的依据是直到连续两次称量误差不得超过0.001g为止.
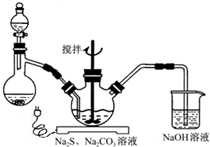 NaCN为剧毒无机物.某化学兴趣小组查阅资料得知,实验室里的氰化钠溶液可使用硫代硫酸钠溶液进行统一解毒销毁,他们开展了以下三个实验,根据要求回答问题:
NaCN为剧毒无机物.某化学兴趣小组查阅资料得知,实验室里的氰化钠溶液可使用硫代硫酸钠溶液进行统一解毒销毁,他们开展了以下三个实验,根据要求回答问题: