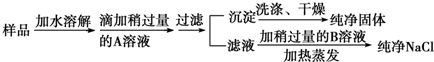
题目内容
14.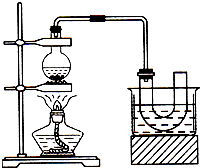 实验室制备溴乙烷(C2H5Br)的装置和步骤如图(已知溴乙烷的沸点38.4℃):
实验室制备溴乙烷(C2H5Br)的装置和步骤如图(已知溴乙烷的沸点38.4℃):①检查装置的气密性,向装置图所示的U形管和大烧杯中加入冰水;
②在圆底烧瓶中加入10mL 95%乙醇、28mL 78%浓硫酸,然后加入13g溴化钠和几粒碎瓷片;
③小心加热.使其充分反应.
回答下列问题:
(1)该实验制取溴乙烷的化学方程式为NaBr+H2SO4+C2H5OH$\stackrel{△}{→}$NaHSO4+C2H5Br+H2O.
(2)反应时若温度过高,可看到有红棕色气体产生,该气体分子式为Br2.
(3)为了更好的控制温度,除用图示的小火加热外,更好的加热方式为水浴加热.
(4)U形管内可观察到的现象是有油状液体生成.
(5)反应结束后,U形管内粗制的C2H5Br呈棕黄色.为了除去粗产品中的杂质,可以选择下列试剂中的C(填序号).
A.NaOH溶液 B.H2O C.Na2SO3溶液 D.CCl4
所需的主要玻璃仪器为分液漏斗,要进一步制得纯净的C2H5Br,可用水洗,然后加入无水CaCl2,再进行蒸馏(填操作名称).
分析 (1)乙醇、浓硫酸和溴化钠加热反应生成溴乙烷、硫酸氢钠和水;
(2)浓硫酸具有强氧化性,温度过高会把溴离子氧化成红棕色的溴;
(3)水浴加热优点:便于控制温度,受热均匀;
(4)U型管得到了溴乙烷;
(5)溴乙烷中混有溴,除杂时注意溴和溴乙烷的性质角度考虑;分液用到分液漏斗;将溴乙烷与水分离采用蒸馏操作.
解答 解:(1)溴化钠、浓硫酸和乙醇制取溴乙烷的化学方程式为:NaBr+H2SO4+C2H5OH$\stackrel{△}{→}$NaHSO4+C2H5Br+H2O,
故答案为:NaBr+H2SO4+C2H5OH$\stackrel{△}{→}$NaHSO4+C2H5Br+H2O;
(2)由于浓硫酸具有强氧化性,会有溴生成,化学式为Br2,
故答案为:Br2;
(3)依据溴乙烷(沸点为38.4℃),可知温度应控制在38.4℃以下,所以可以使用水浴加热,能够更好的控制温度,且受热均匀;
故答案为:水浴加热;
(4)在U型管内有制取的溴乙烷,所以现象是有油状液体生成,
故答案为:有油状液体生成;
(5)粗制的C2H5Br呈棕黄色,说明含有单质溴杂质,则
A.溴乙烷能够与氢氧化钠反应,故A错误;
B.溴在溴乙烷中的溶解度比在水中大,加水难以除去溴乙烷中的溴,故B错误;
C.Na2SO3与溴发生氧化还原反应,Na2SO3可除去溴,故C制取;
D.溴和溴乙烷都能溶于四氯化碳,不能将二者分离,故D错误;
分液使用的主要仪器是分液漏斗;要进一步制得纯净的C2H5Br,可用水洗,然后加入无水CaCl2,利用沸点不同再进行蒸馏分离,
故答案为:C;分液漏斗;蒸馏.
点评 本题主要考查了溴乙烷的制备,掌握相关物质的基本化学性质,是解答本题的关键,平时须注意积累相关反应知识,本题难度中等.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
2.肼(N2H4)与N2O4,是火箭发射中最常用的燃料与助燃剂.
(1)已知2N2H4(l)+N2O4(l)═3N2(g)+4H2O(l)△H=-1225kJ.mol-1
则使1mol N2O4 (l)完全分解成相应的原子时需要吸收的能量是1793kJ.
(2)800℃时,某密闭容器中存在如下反应:2NO2(g)?2NO(g)+O2(g)△H>0,若开始向容器中加入1mol/L的NO2,反应过程中NO的产率随时间的变化如下图曲线Ⅰ所示.

①请在图中绘制出在其它条件与反应I相同时,反应在820℃时进行,NO的产率随时间的变化曲线.
②800℃时,若开始时向容器中同时加入1mol/L NO、0.2mol/L O2、0.5mol/L NO2,则v(正)>v(逆)(填“>”或“<”或“=”或“无法确定”).
(3)己知N2O4(g)?2NO2(g)△H=+57.20 kJ/mol,t时,将一定量的NO2、N2O4,充人一个容器为2L的恒容密闭容器中,两种物质的浓度随时间变化关系如表所示:
①该反应的平衡常数K=0.9.
②前10min内用NO2表示的反应速率为0.04mol/(L.min),20min时改变的条件是增大NO2的浓度;重新达到平衡时,NO2的百分含量b(填选项前字母).
a.增大 b.减小 c.不变 d.无法判断.
(1)已知2N2H4(l)+N2O4(l)═3N2(g)+4H2O(l)△H=-1225kJ.mol-1
| 化学键 | N-H | N-N | N≡N | O-H |
| 键能(kJ.mol-1) | 390 | 190 | 946 | 460 |
(2)800℃时,某密闭容器中存在如下反应:2NO2(g)?2NO(g)+O2(g)△H>0,若开始向容器中加入1mol/L的NO2,反应过程中NO的产率随时间的变化如下图曲线Ⅰ所示.

①请在图中绘制出在其它条件与反应I相同时,反应在820℃时进行,NO的产率随时间的变化曲线.
②800℃时,若开始时向容器中同时加入1mol/L NO、0.2mol/L O2、0.5mol/L NO2,则v(正)>v(逆)(填“>”或“<”或“=”或“无法确定”).
(3)己知N2O4(g)?2NO2(g)△H=+57.20 kJ/mol,t时,将一定量的NO2、N2O4,充人一个容器为2L的恒容密闭容器中,两种物质的浓度随时间变化关系如表所示:
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| c(X)/(mol/L) | 0.2 | c | 0.6 | 0.6 | 1.0 | c1 | c1 |
| c(Y)/(mol/L) | 0.6 | c | 0.4 | 0.4 | 0.4 | c2 | c2 |
②前10min内用NO2表示的反应速率为0.04mol/(L.min),20min时改变的条件是增大NO2的浓度;重新达到平衡时,NO2的百分含量b(填选项前字母).
a.增大 b.减小 c.不变 d.无法判断.
3.工业制H2SO4时,对SO2净化和干燥的目的是( )
①除尘,避免催化剂中毒;②洗涤,避免催化剂中毒;③干燥,避免催化剂中毒; ④干燥,避免设备腐蚀.
①除尘,避免催化剂中毒;②洗涤,避免催化剂中毒;③干燥,避免催化剂中毒; ④干燥,避免设备腐蚀.
| A. | ①②③ | B. | ①②④ | C. | ①④ | D. | ①②③④ |
4.根据实验室测定硫酸铜晶体(CuSO4•5H2O)结晶水含量的实验,填写下列空白.
(1)除需要酒精灯、玻璃棒、坩埚钳、药匙、三脚架等仪器外,从下列仪器中选出所需仪器(用标号字母填写)ABDF.
A.电子天平 B.研钵 C.试管夹 D.坩埚 E.蒸发皿 F.干燥器 G.石棉网
还需要的仪器是泥三角.
(2)某学生实验后得到以下数据:
请写出结晶水x=4.81.本次实验的相对误差=-3.8%.
(3)该学生测定结果是偏高还是偏低?偏低.从下列选项中选出该学生产生误差的原因可能是(填写字母)BC.
A.加热前称量时容器未完全干燥 B.最后两次加热后的质量相差较大(大于0.001g)
C.加热后容器未放入干燥器中冷却 D.加热过程中晶体有少量溅失.
(4)测定硫酸铜晶体中结晶水的含量,至少在天平上进行四次称量,第三、四次称量的目的是进行恒重操作,判断达到恒重的依据是直到连续两次称量误差不得超过0.001g为止.
(1)除需要酒精灯、玻璃棒、坩埚钳、药匙、三脚架等仪器外,从下列仪器中选出所需仪器(用标号字母填写)ABDF.
A.电子天平 B.研钵 C.试管夹 D.坩埚 E.蒸发皿 F.干燥器 G.石棉网
还需要的仪器是泥三角.
(2)某学生实验后得到以下数据:
| 加热前的质量 | 加热后的质量 | ||
| W1(容器) | W2(容器+晶体) | W3(容器+无水硫酸铜) | |
| 第一次 | 15.688g | 17.668g | 16.962g |
| 第二次 | 15.688g | 17.744g | 17.033g |
(3)该学生测定结果是偏高还是偏低?偏低.从下列选项中选出该学生产生误差的原因可能是(填写字母)BC.
A.加热前称量时容器未完全干燥 B.最后两次加热后的质量相差较大(大于0.001g)
C.加热后容器未放入干燥器中冷却 D.加热过程中晶体有少量溅失.
(4)测定硫酸铜晶体中结晶水的含量,至少在天平上进行四次称量,第三、四次称量的目的是进行恒重操作,判断达到恒重的依据是直到连续两次称量误差不得超过0.001g为止.
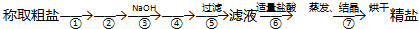
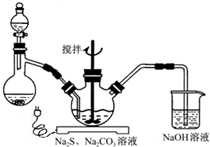 NaCN为剧毒无机物.某化学兴趣小组查阅资料得知,实验室里的氰化钠溶液可使用硫代硫酸钠溶液进行统一解毒销毁,他们开展了以下三个实验,根据要求回答问题:
NaCN为剧毒无机物.某化学兴趣小组查阅资料得知,实验室里的氰化钠溶液可使用硫代硫酸钠溶液进行统一解毒销毁,他们开展了以下三个实验,根据要求回答问题:
 图为实验室制溴苯的实验装置图,请根据图回答下列问题
图为实验室制溴苯的实验装置图,请根据图回答下列问题 .
.