题目内容
19.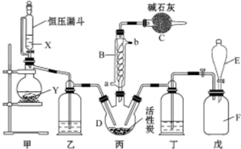 磺酰氯(SO2Cl2)是一种重要的有机合成试剂,实验室可利用SO2与Cl2反应制取少量的SO2Cl2,装置如图(有些夹持装置省略)所示.已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈的水解反应,并产生白雾.
磺酰氯(SO2Cl2)是一种重要的有机合成试剂,实验室可利用SO2与Cl2反应制取少量的SO2Cl2,装置如图(有些夹持装置省略)所示.已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈的水解反应,并产生白雾.(1)仪器B的名称是球形冷凝管,由它的使用可知SO2与Cl2反应的△H<0(填“>”或“<”),仪器C的作用是吸收逸出都有毒的Cl2、SO2,防止空气中的水蒸气进入C,防止污染环境及磺酰氯水解.
(2)仪器组装完毕后,检验甲装置气密性的操作是塞好恒压漏斗上方的塞子,将蒸馏烧瓶的导气管进入水中,酒精灯微热,导管口有气泡产生,停止加热,导管口有一段液柱产生,则装置的气密性良好,表明装置气密性良好.
(3)试剂X、Y的组合最好是c.
a.18.4mol/L H2SO4+Cu b.4mol/L HNO3+Na2SO3 c.60% H2SO4+K2SO3
(4)戊是贮气装置,则E中的试剂是饱和食盐水;若缺少装置乙和丁,潮湿的氯气和二氧化硫之间发生反应的化学方程式是SO2+Cl2+2H2O=H2SO4+2HCl.
(5)反应结束后,将丙中混合物分离开的实验操作是蒸馏.若反应中消耗的氯气的体积为896mL(已转化为标准状况,SO2足量),最后得到纯净的磺酰氯3.3g,则磺酰氯的产率为61.1%(保留三位有效数字).
分析 由(4)戊是贮氯气装置,可知甲装置制备二氧化硫,二氧化硫与氯气在丙中反应生成SO2Cl2,丙中活性炭可能起催化剂作用,SO2Cl2遇水发生剧烈的水解反应,乙为干燥二氧化硫,E中盛放溶液加入戊中排出装置内氯气,可以是饱和食盐水,降低氯气溶解度,丁干燥氯气,SO2Cl2沸点低、易挥发,B为冷凝管,使挥发的产物SO2Cl2冷凝回流,碱石灰吸收为反应的二氧化硫、氯气,防止污染空气,并吸收空气中的水蒸气,防止进入C中导致磺酰氯水解.
1)根据装置图可知,仪器B的名称为球形冷凝管,作用是冷凝回流而反应又没有加热,据此判断SO2与氯气间的反应的热效应,由于会有一部分Cl2、SO2通过冷凝管逸出,故C中应使用碱性试剂,又因SO2Cl2遇水易水解,故碱石灰是用于吸收氯气、SO2并防止空气中的水蒸气进入B中;
(2)可以利用甲装置中空气热胀冷缩产生压强差的原理来检验气密性;
(3)甲是制备SO2的装置,铜与浓硫酸反应需要加热,硝酸能氧化SO2,据此答题;
(4)因氯水不溶于饱和食盐水,故E中的试剂是饱和食盐水.氯气在水存在的条件下可将SO2氧化成硫酸,自身被还原为HCl.
(5)分离沸点不同的液体可以用蒸馏的方法,标准状况下,896mlCl2为0.04mol,故理论上可得到0.04molSO2Cl2,由此可求出产率.
解答 解:(1)根据装置图可知,仪器B的名称为球形冷凝管,因蛇形冷凝管的作用是冷凝回流而反应又没有加热,故SO2与氯气间的反应为放热反应,由于会有一部分Cl2、SO2通过冷凝管逸出,故C中应使用碱性试剂,又因SO2Cl2遇水易水解,故碱石灰是用于吸收氯气、SO2并防止空气中的水蒸气进入B中,
故答案为:球形冷凝管;<;吸收逸出都有毒的Cl2、SO2,防止空气中的水蒸气进入C,防止污染环境及磺酰氯水解;
(2)检验甲装置气密性的方法是:塞好恒压漏斗上方的塞子,将蒸馏烧瓶的导气管进入水中,酒精灯微热,导管口有气泡产生,停止加热,导管口有一段液柱产生,则装置的气密性良好,
故答案为:塞好恒压漏斗上方的塞子,将蒸馏烧瓶的导气管进入水中,酒精灯微热,导管口有气泡产生,停止加热,导管口有一段液柱产生,则装置的气密性良好;
(3)甲是制备SO2的装置,铜与浓硫酸反应需要加热,硝酸能氧化SO2,所以用c.60% H2SO4+K2SO3来制备SO2,故选c;
(4)因氯水不溶于饱和食盐水,故E中的试剂是饱和食盐水,氯气在水存在的条件下可将SO2氧化成硫酸,自身被还原为HCl,反应的方程式为SO2+Cl2+2H2O=H2SO4+2HCl,
故答案为:饱和食盐水;SO2+Cl2+2H2O=H2SO4+2HCl;
(5)分离沸点不同的液体可以用蒸馏的方法,所以丙中混合物分离开的实验操作是蒸馏,标准状况下,896mlCl2为0.04mol,故理论上可得到0.04molSO2Cl2,即为0.04×135g=5.4g,所以SO2Cl2的产为$\frac{3.3g}{5.4g}$×100%=61.1%,故答案为:蒸馏;61.1%.
点评 本题考查实验制备方案,为高考常见题型,侧重于学生的分析、实验和计算能力的考查,涉及对反应原理、装置及操作的分析评价、对仪器的识别、物质的分离提纯等,注意对物质性质信息的应用,难度中等.

 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案(1)除需要酒精灯、玻璃棒、坩埚钳、药匙、三脚架等仪器外,从下列仪器中选出所需仪器(用标号字母填写)ABDF.
A.电子天平 B.研钵 C.试管夹 D.坩埚 E.蒸发皿 F.干燥器 G.石棉网
还需要的仪器是泥三角.
(2)某学生实验后得到以下数据:
| 加热前的质量 | 加热后的质量 | ||
| W1(容器) | W2(容器+晶体) | W3(容器+无水硫酸铜) | |
| 第一次 | 15.688g | 17.668g | 16.962g |
| 第二次 | 15.688g | 17.744g | 17.033g |
(3)该学生测定结果是偏高还是偏低?偏低.从下列选项中选出该学生产生误差的原因可能是(填写字母)BC.
A.加热前称量时容器未完全干燥 B.最后两次加热后的质量相差较大(大于0.001g)
C.加热后容器未放入干燥器中冷却 D.加热过程中晶体有少量溅失.
(4)测定硫酸铜晶体中结晶水的含量,至少在天平上进行四次称量,第三、四次称量的目的是进行恒重操作,判断达到恒重的依据是直到连续两次称量误差不得超过0.001g为止.
①发电厂的煤经脱硫处理
②采用新科学技术促进煤、石油、天然气的开采,以满足工业发展的需求
③将煤转化为水煤气作燃料
④回收并合理处理聚乙烯塑料废物
⑤汽车尾气中含有氮氧化物,是因为汽油燃烧不充分所致,很少,不必考虑
⑥电镀废液经中和后直接排放
⑦增加燃煤发电厂烟囱的高度,可以减少对大气的污染.
| A. | ①②④⑤ | B. | ②③⑥⑦ | C. | ②⑤⑥⑦ | D. | ①③⑥⑦ |
| A. | ⑤④①③② | B. | ④①②⑤③ | C. | ②⑤④①③ | D. | ①④②⑤③ |
| A. | 升高温度,正反应的反应速率变快,逆反应速率变慢,平衡向正反应方向移动 | |
| B. | 减小反应物浓度,逆反应的速率变慢,正反应速率变快,平衡向正反应方向移动 | |
| C. | 增大压强,正反应的反应速率加快,逆反应速率也加快,平衡向正反应方向移动 | |
| D. | 加入正催化剂,对正反应的反应速率影响更大 |
 图为实验室制溴苯的实验装置图,请根据图回答下列问题
图为实验室制溴苯的实验装置图,请根据图回答下列问题 .
.