题目内容
计算题
①标准状况下,1体积水中溶解700体积的氨气,所得溶液的密度为0.9g/cm3,求所得溶液的物质的量浓度.
②有一块表面被氧化成氧化钠的金属钠,质量为5.22g,放入足量水中,当反应结束时,在标准状况下生成氢气0.2g,求被氧化的钠的质量.
①标准状况下,1体积水中溶解700体积的氨气,所得溶液的密度为0.9g/cm3,求所得溶液的物质的量浓度.
②有一块表面被氧化成氧化钠的金属钠,质量为5.22g,放入足量水中,当反应结束时,在标准状况下生成氢气0.2g,求被氧化的钠的质量.
考点:物质的量浓度的相关计算,化学方程式的有关计算
专题:计算题
分析:①假定水为1L,氨气为700L,根据n=
计算氨气的物质的量,再根据m=nM计算氨气的质量,根据m=ρV计算水的质量,进而计算溶液的质量,利用V=
计算溶液的体积,再根据c=
计算氨水的物质的量浓度.
②根据反应:2Na+2H2O=2NaOH+H2↑计算样品中金属Na的质量,进而计算氧化钠的质量,根据氧化钠中Na元素质量分数计算被氧化成氧化钠的钠的质量.
| V |
| Vm |
| m |
| ρ |
| n |
| V |
②根据反应:2Na+2H2O=2NaOH+H2↑计算样品中金属Na的质量,进而计算氧化钠的质量,根据氧化钠中Na元素质量分数计算被氧化成氧化钠的钠的质量.
解答:
解:①假定水为1L,氨气为700L,则:
1L水的质量为:1000mL×1g/mL=1000g,
氨气的物质的量为
=
mol,氨气的质量为
mol×17g/mol=
g
所以氨水的体积为:
=
L,
故氨水的物质的量浓度为
=18.4 mol/L,
答:所得氨水溶液的物质的量浓度为18.4mol/L;
②反应生成氢气的质量为0.2g,则:
2Na+2H2O=2NaOH+H2↑
46 2
m(Na) 0.2g
m(Na)=
=4.6g,
m(Na2O)=5.22g-4.6g=0.62g,则被氧化成氧化钠的金属钠的质量=0.62g×
=0.46g,
答:被氧化成氧化钠的金属钠的质量为0.46g.
1L水的质量为:1000mL×1g/mL=1000g,
氨气的物质的量为
| 700L |
| 22.4L/mol |
| 700 |
| 22.4 |
| 700 |
| 22.4 |
| 17×700 |
| 22.4 |
所以氨水的体积为:
1000g+
| ||
| 900g/L |
| 224+17×7 |
| 9×22.4 |
故氨水的物质的量浓度为
| ||
|
答:所得氨水溶液的物质的量浓度为18.4mol/L;
②反应生成氢气的质量为0.2g,则:
2Na+2H2O=2NaOH+H2↑
46 2
m(Na) 0.2g
m(Na)=
| 46×0.2g |
| 2 |
m(Na2O)=5.22g-4.6g=0.62g,则被氧化成氧化钠的金属钠的质量=0.62g×
| 46 |
| 62 |
答:被氧化成氧化钠的金属钠的质量为0.46g.
点评:本题考查物质的量浓度计算、化学方程式的有关计算等,难度不大,(1)中注意对公式的理解.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
下列物质属于纯净物的是( )
| A、石油 | B、石油液化气 |
| C、煤 | D、蒸馏水 |
下列有关物质的性质属于物理性质的是( )
| A、硫酸的酸性 |
| B、盐酸的挥发性 |
| C、碳酸的不稳定性 |
| D、氢气的还原性 |
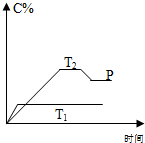 在一定条件下,可逆反应A+B?mC变化如图所示.已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,P为反应在T2温度时达到平衡后向容器加压的变化情况,问:
在一定条件下,可逆反应A+B?mC变化如图所示.已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,P为反应在T2温度时达到平衡后向容器加压的变化情况,问: