题目内容
8.常温下,有甲、乙两份体积为1L,浓度均为0.1mol•L-1的醋酸溶液,其pH为3,①甲用蒸馏水稀释100倍后,溶液的pH变为x;②乙与等体积、浓度为0.2mol•L-1的NaOH混合,在混合液中:n(CH3COO-)+n(OH-)-n(H+)=y mol,x、y的正确答案组合为( )| A. | 5; 0.1 | B. | 5; 0.2 | C. | 3<x<5; 0.1 | D. | 3<x<5; 0.2 |
分析 醋酸为弱电解质,加水稀释促进电离,0.1mol/L的醋酸用蒸馏水稀释100倍后,溶液的3<pH<5,与等体积、浓度为0.2mol/L的NaOH混合,可从电荷守恒的角度分析.
解答 解:醋酸为弱电解质,加水稀释促进电离,0.1mol/L的醋酸用蒸馏水稀释100倍后,溶液的3<pH<5,
与等体积、浓度为0.2mol/L的NaOH混合,
根据电荷守恒可知:n(Na+)+n(H+)=n(OH-)+n(CH3COO-),
则n(CH3COO-)+n(OH-)-n(H+)=n(Na+)=ymol,
n(Na+)=0.2mol/L×1L=0.2mol,
所以y=0.2,
故选D.
点评 本题考查酸碱混合的计算和判断,题目难度中等,注意把握弱电解质的电离特征,结合溶液的电中性原则解答该题.

练习册系列答案
相关题目
16.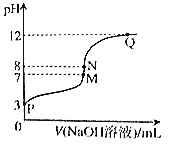 T℃时,在20.00mL0.10mol•L-1CH3COOH溶液中滴入0.10mol•L-1NaOH溶液,溶液pH与NaOH溶液体积关系关系如图所示.下列说法正确的是( )
T℃时,在20.00mL0.10mol•L-1CH3COOH溶液中滴入0.10mol•L-1NaOH溶液,溶液pH与NaOH溶液体积关系关系如图所示.下列说法正确的是( )
 T℃时,在20.00mL0.10mol•L-1CH3COOH溶液中滴入0.10mol•L-1NaOH溶液,溶液pH与NaOH溶液体积关系关系如图所示.下列说法正确的是( )
T℃时,在20.00mL0.10mol•L-1CH3COOH溶液中滴入0.10mol•L-1NaOH溶液,溶液pH与NaOH溶液体积关系关系如图所示.下列说法正确的是( )| A. | T℃时,CH3COOH电离平衡常数Ka=1.0×10-3 | |
| B. | M点对应的NaOH溶液体积为20.00mL | |
| C. | N点与Q点所示溶液中水的电离程度:N>Q | |
| D. | N点所示溶液中c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
13.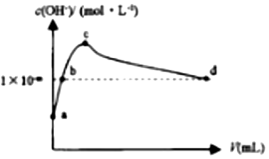 常温下,向1LpH=10的NaOH溶液中持续通入CO2.通入CO2的体积(V)与溶液中水电离出的c(OH-)的关系如图所示.下列叙述不正确的是( )
常温下,向1LpH=10的NaOH溶液中持续通入CO2.通入CO2的体积(V)与溶液中水电离出的c(OH-)的关系如图所示.下列叙述不正确的是( )
 常温下,向1LpH=10的NaOH溶液中持续通入CO2.通入CO2的体积(V)与溶液中水电离出的c(OH-)的关系如图所示.下列叙述不正确的是( )
常温下,向1LpH=10的NaOH溶液中持续通入CO2.通入CO2的体积(V)与溶液中水电离出的c(OH-)的关系如图所示.下列叙述不正确的是( )| A. | a点溶液中:水电离出的c(H+)=1×10-10mol•L-1 | |
| B. | b点溶液中:c(H+)=1×10-mmol•L-1 | |
| C. | c点溶液中:c(Na+)>c(HCO3-)>c(CO32-) | |
| D. | d点溶液中:c(Na+)+c(H+)═2c(CO32-)+c(HCO3-)+c(OH-) |
20.下列分子或离子中不能跟质子结合的是( )
| A. | NH3 | B. | H2O | C. | Ca2+ | D. | OH- |
17.某元素R的最高价氧化物的水化物分子式是H3RO4,则在气态氢化物中R元素的化合价是( )
| A. | -1 | B. | -2 | C. | -3 | D. | -4 |
18.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 将FeCl3溶液加入Mg(OH)2悬浊液中 | 观察到沉淀由白色变为红褐色 | Fe(OH)3的溶解度大于Mg(OH)2 |
| B | 向某溶液中滴加BaCl2溶液,随后加稀硝酸酸化 | 溶液中产生白色沉淀,加稀硝酸不溶解 | 原溶液中一定含有SO42- |
| C | 将稀硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中 | 溶液变黄色 | 氧化性:H2O2比Fe3+强 |
| D | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| A. | A | B. | B | C. | C | D. | D |
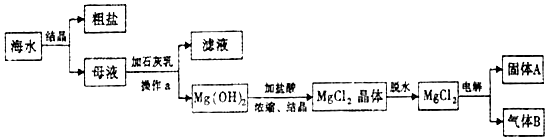
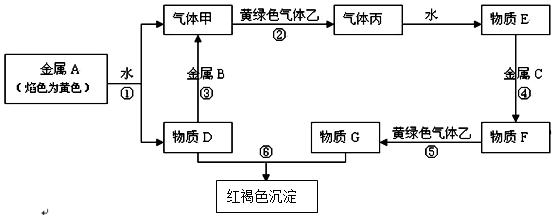
 .
.