题目内容
18.我省地处东南沿海,海域面积大,海洋资源十分丰富,从海水中可提取多种化工原料.如图是某工厂利用海水提取镁的工业流程:请回答下列各题:
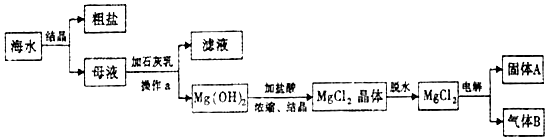
(1)操作a的名称是过滤;
(2)固体A是镁,气体B是氯气;
(3)海水中的镁元素为化合态(填“游离态“或”化合态“).
分析 海水结晶得到粗盐和母液,母液加入石灰乳沉镁离子生成氢氧化镁沉淀,过滤后的沉淀中加入盐酸生成氯化镁溶液,浓缩结晶得到氯化镁晶体,氯化氢气流中失水得到氯化镁,电解熔融氯化镁得到镁和氯气,所以固体A为镁,气体B为氯气,据此答题.
解答 解:海水结晶得到粗盐和母液,母液加入石灰乳沉镁离子生成氢氧化镁沉淀,过滤后的沉淀中加入盐酸生成氯化镁溶液,浓缩结晶得到氯化镁晶体,氯化氢气流中失水得到氯化镁,电解熔融氯化镁得到镁和氯气,所以固体A为镁,气体B为氯气,
(1)根据上面的分析可知,操作a的名称是过滤,
故答案为:过滤;
(2)根据上面的分析可知,固体A为镁,气体B为氯气,
故答案为:镁;氯气;
(3)海水中的镁元素主要以氯化镁形式存在,所以是化合态的形式存在,
故答案为:化合态.
点评 本题考查较综合,涉及粗盐提纯、氧化还原反应判断,离子方程式书写等,为高考常见题型,利用所学知识结合流程图信息是解答本题的关键,题目难度中等.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
10.下列过程中,最终的白色沉淀不一定是BaSO4的是( )
| A. | Ba(NO3)2溶液$\stackrel{通入SO_{2}}{→}$白色沉淀 | |
| B. | 无色溶液$\stackrel{稀HNO_{3}}{→}$ $\stackrel{BaCl_{2}溶液}{→}$白色沉淀 | |
| C. | Ba(NO3)2溶液$\stackrel{加过量HCl}{→}$无现象 $\stackrel{Na_{2}SO_{4}}{→}$白色沉淀 | |
| D. | Fe(NO3)2溶液$\stackrel{加过量HCl}{→}$ $\stackrel{通入SO_{2}}{→}$ $\stackrel{BaCl_{2}}{→}$白色沉淀 |
11.已知2H2(g)+O2(g)=2H2O(l)+571.6KJ.下列说法错误的是( )
| A. | 2mol液态水完全分解成氢气与氧气,需吸收571.6KJ热量 | |
| B. | 2mol氢气与1mol氧气的总能量大于2mol 液态水的总能量 | |
| C. | 2 g 氢气与16 g氧气完全反应生成18g液态水放出285.8 KJ热量 | |
| D. | 2mol氢气与1mol氧气完全反应生成水蒸汽放出的热量大于571.6KJ |
6.将4mol A气体和2mol B气体在2L的容器中混合,并在一定条件下发生如下反应:2A(g)+B(g)=2C(g),若经2s后测得C的物质的量为0.6mol.下列叙述正确的是( )
| A. | 用物质C表示的反应的平均速率为0.3 mol•L-1•s-1 | |
| B. | 反应开始到2 s,物质B的物质的量浓度减少了0.85 mol/L | |
| C. | 2 s时物质A的转化率为15% | |
| D. | 2v(A)=v(B) |
13.由乙烯推测丙烯(CH2=CHCH3)的结构或性质正确的是( )
| A. | 不能使酸性高锰酸钾溶液褪色 | |
| B. | 所有原子都在同一平面上 | |
| C. | 能使溴水褪色 | |
| D. | 与HCl在一定条件下能加成只得到一种产物 |
3. 某学习小组的同学利用实验的方法探究一定温度下,双氧水浓度、催化剂用量(浓度)对H2O2分解速率的影响,实验内容如表所示,实验装置如图所示:
某学习小组的同学利用实验的方法探究一定温度下,双氧水浓度、催化剂用量(浓度)对H2O2分解速率的影响,实验内容如表所示,实验装置如图所示:
(1)V1=4;若V2=5,t3<t1,则由实验①、③可以得出的结论是增大催化剂浓度,可加快反应速率.
(2)实验②中0~5s内用H2O2物质的量浓度表示的反应速率为$\frac{a}{560}mol•{L}^{-1}•{s}^{-1}$.
(3)在图的方框中绘制出相应的装置.
(4)有人认为Fe3+催化H2O2分解的过程可分为两个阶段:①2Fe3++H2O2=2Fe2++O2↑+2H+,写出第二个阶段反应的离子方程式:2Fe2++H2O2+2H+=2Fe3++2H2O.
 某学习小组的同学利用实验的方法探究一定温度下,双氧水浓度、催化剂用量(浓度)对H2O2分解速率的影响,实验内容如表所示,实验装置如图所示:
某学习小组的同学利用实验的方法探究一定温度下,双氧水浓度、催化剂用量(浓度)对H2O2分解速率的影响,实验内容如表所示,实验装置如图所示:| 实验序号 | 参加反应的物质 | 收集amL(在标准状况下)O2所需时间/s | ||||
| 酸性Fe2(SO4)3溶液 | H2O2溶液 | H2O | ||||
| V/mL | c/mol•L-1 | V/mL | c/mol•L-1 | V/mL | ||
| ① | 4 | 0.1 | 3 | 4 | 3 | t1 |
| ② | 4 | 0.1 | 2 | 4 | V1 | 5 |
| ③ | V2 | 0.1 | V3 | 4 | 2 | t3 |
(2)实验②中0~5s内用H2O2物质的量浓度表示的反应速率为$\frac{a}{560}mol•{L}^{-1}•{s}^{-1}$.
(3)在图的方框中绘制出相应的装置.
(4)有人认为Fe3+催化H2O2分解的过程可分为两个阶段:①2Fe3++H2O2=2Fe2++O2↑+2H+,写出第二个阶段反应的离子方程式:2Fe2++H2O2+2H+=2Fe3++2H2O.
10.我国有广阔的海岸线,建设海峡经济区,海水的综合利用大有可为,如图所示为海水综合利用部分流程,有关说法正确的是( )


| A. | 上述工艺流程中涉及到化合、分解、复分解和置换反应 | |
| B. | ①只发生了化学变化,②是工业上用电解熔融NaCl制备Cl2 | |
| C. | ③④涉及的反应均为氧化还原反应,⑤只需要蒸馏即可得到单质Br2 | |
| D. | ④中反应的离子方程式为SO2+Br2+2H2O═4H++SO42-+2Br- |
7.下列实验装置或操作能达到实验目的是( )


| A. | 制取Fe(OH)2的装置及操作 | |
| B. | 某溶液用盐酸酸化后再滴加硝酸钡溶液,检验溶液中是否含有SO42- | |
| C. | 向滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后溶液的红色褪去,可证明Na2CO3溶液显碱性是由于CO32-水解造成的 | |
| D. | 将氯化铁饱和滚液与稀氨水混合,加热至沸腾,制备Fe(OH)3胶体 |
8.常温下,有甲、乙两份体积为1L,浓度均为0.1mol•L-1的醋酸溶液,其pH为3,①甲用蒸馏水稀释100倍后,溶液的pH变为x;②乙与等体积、浓度为0.2mol•L-1的NaOH混合,在混合液中:n(CH3COO-)+n(OH-)-n(H+)=y mol,x、y的正确答案组合为( )
| A. | 5; 0.1 | B. | 5; 0.2 | C. | 3<x<5; 0.1 | D. | 3<x<5; 0.2 |