题目内容
13. 常温下,向1LpH=10的NaOH溶液中持续通入CO2.通入CO2的体积(V)与溶液中水电离出的c(OH-)的关系如图所示.下列叙述不正确的是( )
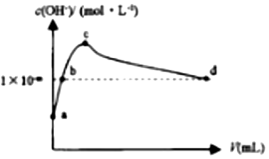
常温下,向1LpH=10的NaOH溶液中持续通入CO2.通入CO2的体积(V)与溶液中水电离出的c(OH-)的关系如图所示.下列叙述不正确的是( )| A. | a点溶液中:水电离出的c(H+)=1×10-10mol•L-1 | |
| B. | b点溶液中:c(H+)=1×10-mmol•L-1 | |
| C. | c点溶液中:c(Na+)>c(HCO3-)>c(CO32-) | |
| D. | d点溶液中:c(Na+)+c(H+)═2c(CO32-)+c(HCO3-)+c(OH-) |
分析 A.a点溶液中的溶质是NaOH,水电离出的c(H+)=10-pH;
B.由水的电离方程式可知,水电离出的氢离子与氢氧根离子的浓度相等;
C.c点溶液中,当水电离出的OH-离子浓度最大时,说明此时的溶液是碳酸钠溶液,碳酸根离子水解生成碳酸氢根离子但程度较小;
D.d点溶液中,溶液中存在电荷守恒,根据电荷守恒判断.
解答 解:A.a点溶液中的溶质是NaOH,水电离出的c(H+)=10-pH=1×10-10mol•L-1,故A正确;
B.常温下,c水(OH-)=c水(H+)=1×10-mmol/L,故B正确;
C.c点溶液中,当水电离出的OH-离子浓度最大时,说明此时的溶液是碳酸钠溶液,碳酸根离子水解生成碳酸氢根离子但程度较小,所以离子浓度大小顺序是c(Na+)>c(CO32-)>c(HCO3-),故C错误;
D.d点溶液中,溶液中存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)═2c(CO32-)+c(HCO3-)+c(OH-),故D正确;
故选C.
点评 本题考查离子浓度大小比较,为高频考点,明确溶液中的溶质及其性质是解本题关键,结合电荷守恒进行解答,注意计算碱性溶液中水电离出氢离子和氢氧根离子的方法.

练习册系列答案
相关题目
3.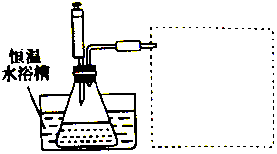 某学习小组的同学利用实验的方法探究一定温度下,双氧水浓度、催化剂用量(浓度)对H2O2分解速率的影响,实验内容如表所示,实验装置如图所示:
某学习小组的同学利用实验的方法探究一定温度下,双氧水浓度、催化剂用量(浓度)对H2O2分解速率的影响,实验内容如表所示,实验装置如图所示:
(1)V1=4;若V2=5,t3<t1,则由实验①、③可以得出的结论是增大催化剂浓度,可加快反应速率.
(2)实验②中0~5s内用H2O2物质的量浓度表示的反应速率为$\frac{a}{560}mol•{L}^{-1}•{s}^{-1}$.
(3)在图的方框中绘制出相应的装置.
(4)有人认为Fe3+催化H2O2分解的过程可分为两个阶段:①2Fe3++H2O2=2Fe2++O2↑+2H+,写出第二个阶段反应的离子方程式:2Fe2++H2O2+2H+=2Fe3++2H2O.
 某学习小组的同学利用实验的方法探究一定温度下,双氧水浓度、催化剂用量(浓度)对H2O2分解速率的影响,实验内容如表所示,实验装置如图所示:
某学习小组的同学利用实验的方法探究一定温度下,双氧水浓度、催化剂用量(浓度)对H2O2分解速率的影响,实验内容如表所示,实验装置如图所示:| 实验序号 | 参加反应的物质 | 收集amL(在标准状况下)O2所需时间/s | ||||
| 酸性Fe2(SO4)3溶液 | H2O2溶液 | H2O | ||||
| V/mL | c/mol•L-1 | V/mL | c/mol•L-1 | V/mL | ||
| ① | 4 | 0.1 | 3 | 4 | 3 | t1 |
| ② | 4 | 0.1 | 2 | 4 | V1 | 5 |
| ③ | V2 | 0.1 | V3 | 4 | 2 | t3 |
(2)实验②中0~5s内用H2O2物质的量浓度表示的反应速率为$\frac{a}{560}mol•{L}^{-1}•{s}^{-1}$.
(3)在图的方框中绘制出相应的装置.
(4)有人认为Fe3+催化H2O2分解的过程可分为两个阶段:①2Fe3++H2O2=2Fe2++O2↑+2H+,写出第二个阶段反应的离子方程式:2Fe2++H2O2+2H+=2Fe3++2H2O.
4.对于平衡体系mA(g)+nB(g)?pC(g)+qD(g)△H=bkJ/mol.下列结论中错误的是( )
| A. | 若温度不变,将容器的体积缩小到原来的一半,达到新平衡时A的浓度为原来的2.2倍,则m+n<p+q | |
| B. | 若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n | |
| C. | 若m+n=p+q,则向含有amol气体的平衡体系中再加入amol的B,达到新平衡时,气体的总物质的量等于2amol | |
| D. | 保持其它条件不变,如升高温度,D的体积分数增大,说明该反应的△H<0 |
1.将CO2通入下列物质的溶液中不与其反应的是( )
①Na2CO3 ②Ca(ClO)2 ③CaCO3④CaCl2.
①Na2CO3 ②Ca(ClO)2 ③CaCO3④CaCl2.
| A. | ①③④ | B. | ①和③ | C. | 只有② | D. | 只有④ |
8.常温下,有甲、乙两份体积为1L,浓度均为0.1mol•L-1的醋酸溶液,其pH为3,①甲用蒸馏水稀释100倍后,溶液的pH变为x;②乙与等体积、浓度为0.2mol•L-1的NaOH混合,在混合液中:n(CH3COO-)+n(OH-)-n(H+)=y mol,x、y的正确答案组合为( )
| A. | 5; 0.1 | B. | 5; 0.2 | C. | 3<x<5; 0.1 | D. | 3<x<5; 0.2 |
18.下列各组元素的电负性大小顺序正确的是( )
| A. | S<N<O<F | B. | S<O<N<F | C. | Si<Na<Mg<Al | D. | Br<H<Zn |
2.实验室里由粗盐制备精盐的实验中,必需的操作步骤有( )
| A. | 分液 | B. | 过滤 | C. | 溶解 | D. | 蒸发结晶 |
 .
.