题目内容
16.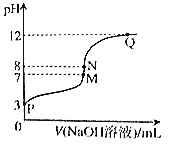 T℃时,在20.00mL0.10mol•L-1CH3COOH溶液中滴入0.10mol•L-1NaOH溶液,溶液pH与NaOH溶液体积关系关系如图所示.下列说法正确的是( )
T℃时,在20.00mL0.10mol•L-1CH3COOH溶液中滴入0.10mol•L-1NaOH溶液,溶液pH与NaOH溶液体积关系关系如图所示.下列说法正确的是( )| A. | T℃时,CH3COOH电离平衡常数Ka=1.0×10-3 | |
| B. | M点对应的NaOH溶液体积为20.00mL | |
| C. | N点与Q点所示溶液中水的电离程度:N>Q | |
| D. | N点所示溶液中c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
分析 根据图象可知,T℃时滴入大量氢氧化钠溶液后溶液的pH保持在12,说明该稳定性0.10mol•L-1NaOH溶液的pH=12,则该温度下水的离子积为Kw=c(OH-)•c(H+)=0.1×1×10-12=1×10-13,溶液为中性时溶液的pH=6.5,
A.根据P点0.1mol/LCH3COOH的pH计算该稳定性醋酸的电离平衡常数;
B.M点pH=7,溶液呈中性,氢氧化钠溶液体积小于20ml.
C.N、Q点都呈碱性,氢氧化钠过量,都抑制了水的电离,溶液碱性越强,抑制程度越大;
D.N点溶液的pH=8,氢氧化钠稍过量,则c(CH3COO-)>c(OH-).
解答 解:根据图象可知,滴入大量氢氧化钠溶液后溶液的pH保持在12,说明该稳定性0.10mol•L-1NaOH溶液的pH=12,则该温度下水的离子积为Kw=c(OH-)•c(H+)=0.1×1×10-12=1×10-13,溶液为中性时溶液的pH=6.5,
A.P点溶液的pH=3,则c(H+)=1×10-3mol/L,c(CH3COO-)≈c(H+),c(CH3COOH)≈0.1mol/L,则T℃时CH3COOH电离平衡常数Ka=$\frac{1×1{0}^{-3}×1×1{0}^{-3}}{0.1}$=1.0×10-5,故A错误;
B.M点溶液的pH=7,则溶液呈中性,此时c(H+)=c(OH-),而醋酸与氢氧化钠反应生成的醋酸钠呈碱性,所以氢氧化钠的体积应小于20ml.故B错误
C.N点与Q点所示溶液中,N、Q都抑制了水的电离,溶液碱性越强,对水的抑制程度越大,则水的电离程度:N>Q,故C正确;
D.N点溶液pH=8>6.5,呈碱性,则c(OH-)>c(H+)、c(Na+)>c(CH3COO-),由于N点氢氧化钠稍过量(滴定突变范围),则c(CH3COO-)>c(OH-),正确的离子浓度大小为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故D错误;
故选C.
点评 本题考查溶液酸碱性与溶液pH的计算,题目难度中等,根据曲线变化正确计算水的离子积为解答关键,注意掌握溶液酸碱性与溶液pH的关系,试题培养了学生的分析、理解能力及综合应能力.

 阅读快车系列答案
阅读快车系列答案| A. | 用物质C表示的反应的平均速率为0.3 mol•L-1•s-1 | |
| B. | 反应开始到2 s,物质B的物质的量浓度减少了0.85 mol/L | |
| C. | 2 s时物质A的转化率为15% | |
| D. | 2v(A)=v(B) |

| A. | 制取Fe(OH)2的装置及操作 | |
| B. | 某溶液用盐酸酸化后再滴加硝酸钡溶液,检验溶液中是否含有SO42- | |
| C. | 向滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后溶液的红色褪去,可证明Na2CO3溶液显碱性是由于CO32-水解造成的 | |
| D. | 将氯化铁饱和滚液与稀氨水混合,加热至沸腾,制备Fe(OH)3胶体 |
| A. | 若温度不变,将容器的体积缩小到原来的一半,达到新平衡时A的浓度为原来的2.2倍,则m+n<p+q | |
| B. | 若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n | |
| C. | 若m+n=p+q,则向含有amol气体的平衡体系中再加入amol的B,达到新平衡时,气体的总物质的量等于2amol | |
| D. | 保持其它条件不变,如升高温度,D的体积分数增大,说明该反应的△H<0 |
| A. | ${\;}_{a+m}^{b+m+n}R$ | B. | ${\;}_{a+m}^{b+a-m}R$ | C. | ${\;}_{a}^{b+a}R$ | D. | ${\;}_{a-m}^{a-m+b}R$ |
①Na2CO3 ②Ca(ClO)2 ③CaCO3④CaCl2.
| A. | ①③④ | B. | ①和③ | C. | 只有② | D. | 只有④ |
| A. | 5; 0.1 | B. | 5; 0.2 | C. | 3<x<5; 0.1 | D. | 3<x<5; 0.2 |
| A. | NaOH+HCl═NaCl+H2O | B. | 2Na2O2+2H2O═4NaOH+O2↑ | ||
| C. | 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ | D. | 2Na+2H2O═2NaOH+H2↑ |
 .
.