题目内容
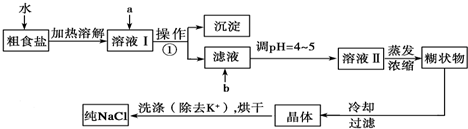
粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇、四氯化碳、稀盐酸.
(1)欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-,选出a所代表的试剂,按滴加顺序依次为 (只填化学式).
(2)如何检验SO42-是否沉淀完全 .
(3)调节pH 的目的 ,试剂b是 (填名称).
(4)洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为 ,使用该试剂的目的是 .

提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇、四氯化碳、稀盐酸.
(1)欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-,选出a所代表的试剂,按滴加顺序依次为
(2)如何检验SO42-是否沉淀完全
(3)调节pH 的目的
(4)洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为
考点:粗盐提纯
专题:实验题
分析:(1)把杂质转化为沉淀或气体除去,除钙离子用碳酸根离子,除镁离子、铁离子用氢氧根离子,除硫酸根离子用钡离子.要注意除杂质的顺序,后加的试剂最好能把前面先加是过量试剂除掉;
(2)硫酸根遇到钡离子会产生白色沉淀;
(3)加适量盐酸可以除掉过量的OH-、CO32-;
(4)氯化钠晶体中混有氯化钾,必须洗涤,可以根据乙醇的性质来回答.
(2)硫酸根遇到钡离子会产生白色沉淀;
(3)加适量盐酸可以除掉过量的OH-、CO32-;
(4)氯化钠晶体中混有氯化钾,必须洗涤,可以根据乙醇的性质来回答.
解答:
解:(1)除去粗盐中的可溶性杂质:Ca2+、Mg2+、Fe3+、SO42-时,可以加入过量NaOH(去除镁离子和铁离子):Mg2++2OH-=Mg(OH)2↓,Fe3++3OH-═Fe(OH)3↓;加入过量BaCl2(去除硫酸根离子):SO42-+Ba2+=BaSO4↓;加入过量Na2CO3(去除钙离子的多余的钡离子):Ca2++CO32-=CaCO3,碳酸钠必须加在氯化钡之后,
故答案为:BaCl2、NaOH、Na2CO3(或NaOH、BaCl2、Na2CO3或BaCl2、Na2CO3、NaOH);
(2)钡离子遇到硫酸根离子会生成白色沉淀,因此可以取上层清液少许于试管中,滴加BaCl2溶液,如无沉淀生成,则表明SO42-已沉淀完全;如有沉淀生成,则表明SO42-未沉淀完全,
故答案为:静置一段时间后,取少量上层清液再滴加BaCl2溶液,若无沉淀生成,说明SO42-沉淀完全,反之未沉淀完全;
(3)加适量盐酸,可以少引入杂质,并且盐酸与过量NaOH溶液和过量Na2CO3溶液发生反应,离子方程式为:H++OH-═H2O,CO32-+2H+═H2O+CO2↑,从而除掉过量的OH-、CO32-;
故答案为:除掉过量的OH-、CO32-;稀盐酸;
(4)粗盐中含有钾离子,所以氯化钠晶体中混有氯化钾,必须进行洗涤,氯化钠不溶于乙醇,可用乙醇冲洗固体表面的氯化钾,这样可以减少晶体的损失,
故答案为:75%乙醇;除去晶体表面的KCl,减少晶体的损耗.
故答案为:BaCl2、NaOH、Na2CO3(或NaOH、BaCl2、Na2CO3或BaCl2、Na2CO3、NaOH);
(2)钡离子遇到硫酸根离子会生成白色沉淀,因此可以取上层清液少许于试管中,滴加BaCl2溶液,如无沉淀生成,则表明SO42-已沉淀完全;如有沉淀生成,则表明SO42-未沉淀完全,
故答案为:静置一段时间后,取少量上层清液再滴加BaCl2溶液,若无沉淀生成,说明SO42-沉淀完全,反之未沉淀完全;
(3)加适量盐酸,可以少引入杂质,并且盐酸与过量NaOH溶液和过量Na2CO3溶液发生反应,离子方程式为:H++OH-═H2O,CO32-+2H+═H2O+CO2↑,从而除掉过量的OH-、CO32-;
故答案为:除掉过量的OH-、CO32-;稀盐酸;
(4)粗盐中含有钾离子,所以氯化钠晶体中混有氯化钾,必须进行洗涤,氯化钠不溶于乙醇,可用乙醇冲洗固体表面的氯化钾,这样可以减少晶体的损失,
故答案为:75%乙醇;除去晶体表面的KCl,减少晶体的损耗.
点评:本题主要考查了粗盐提纯过程中的除杂方面的知识,综合性强,难度一般,要注意除杂质选取和添加的先后顺序.

练习册系列答案
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
下列叙述正确的是( )
| A、碳的摩尔质量为12g |
| B、1mol NaCl的质量是58.5g/mol |
| C、58.5g NaCl所含Na+和Cl-共1mol |
| D、1mol NaCl约含6.02×1023个Cl- |
最近我国学者发现,以精CuFeS2矿为原料在沸腾炉中和O2(空气)反应,生成物冷却后经溶解、除铁、结晶,得到CuSO4?5H2O.实验结果如下下列关于这一过程的叙述错误的是( )
| 沸腾炉炉度/℃ | 560 | 580 | 600 | 620 | 640 | 660 | |
| 生成物 | 水溶性Cu% | 90.12 | 91.24 | 93.50 | 92.38 | 89.96 | 84.23 |
| 酸溶性Cu% | 92.00 | 93.60 | 97.08 | 97.82 | 98.16 | 98.19 | |
| 酸溶性Fe% | 8.56 | 6.72 | 3.46 | 2.78 | 2.37 | 2.28 | |
| A、反应中有二氧化硫生成 |
| B、产物中铜元素主要以氧化物形式存在 |
| C、随温度升高,铁的氧化物在酸中的溶解度降低 |
| D、温度高于600~620℃生成物中水溶性Cu(%)下降的原因是水溶性铜分解所致 |
沸腾时只需克服范德华力的液体物质是( )
| A、水 | B、酒精 | C、溴 | D、水银 |
对于常温下pH为4的氯化铵溶液与醋酸溶液,下列叙述正确的是( )
| A、溶液中c(H+)相等 |
| B、水电离的c(H+)相等 |
| C、两溶液中水的电离程度相等 |
| D、醋酸溶液中水电离的c(H+)多 |
下列离子方程式书写正确的是( )
| A、铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ |
| B、FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl- |
| C、三氯化铁溶液中加入铁粉:Fe3++Fe=2Fe2+ |
| D、AlCl3溶液中加入足量的NaOH溶液:Al3++3OH-═Al(OH)3↓ |
下列物质的鉴别方法正确的是( )
| A、用澄清石灰水鉴别氢气和一氧化碳 |
| B、用无色酚酞鉴别碳酸钠溶液和氢氧化钠溶液 |
| C、用食盐水鉴别硬水和软水 |
| D、用水鉴别硝酸铵固体和氢氧化钠固体 |