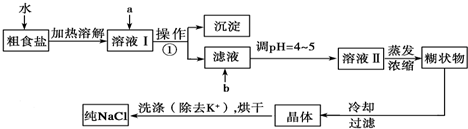
题目内容
最近我国学者发现,以精CuFeS2矿为原料在沸腾炉中和O2(空气)反应,生成物冷却后经溶解、除铁、结晶,得到CuSO4?5H2O.实验结果如下下列关于这一过程的叙述错误的是( )
| 沸腾炉炉度/℃ | 560 | 580 | 600 | 620 | 640 | 660 | |
| 生成物 | 水溶性Cu% | 90.12 | 91.24 | 93.50 | 92.38 | 89.96 | 84.23 |
| 酸溶性Cu% | 92.00 | 93.60 | 97.08 | 97.82 | 98.16 | 98.19 | |
| 酸溶性Fe% | 8.56 | 6.72 | 3.46 | 2.78 | 2.37 | 2.28 | |
| A、反应中有二氧化硫生成 |
| B、产物中铜元素主要以氧化物形式存在 |
| C、随温度升高,铁的氧化物在酸中的溶解度降低 |
| D、温度高于600~620℃生成物中水溶性Cu(%)下降的原因是水溶性铜分解所致 |
考点:金属的回收与环境、资源保护,化学方程式的有关计算
专题:元素及其化合物
分析:水溶性铜化合物为CuSO4?5H2O,酸溶性铜化合物为CuO,温度较高时,CuSO4?5H2O可分解生成CuO,CuFeS2与O2反应放热,可通过控制加入CuFeS2的速度调节温度;表格还用用水溶性铜、酸溶性铜和酸溶性铁的信息表明,沸腾炉里的含铁产物肯定不是铁的硫酸盐,因为并没有说有水溶性铁,因而可以得出结论:燃烧产物中的铁是以氧化物的方式存在的,据此回答即可.
解答:
解:A、精CuFeS2矿为原料在沸腾炉中和O2(空气)反应的方程式为:4CuFeS2+15O2=4CuSO4+2Fe2O3+4SO2↑,故A正确;
B、根据表中数据,产物中酸溶性Cu%量居多,所以产物中铜元素主要以CuSO4形式存在,故B错误;
C、根据表中数据可以看出:随温度升高,铁的氧化物在酸中的溶解度降低,故C正确;
D、水溶性铜化合物为CuSO4?5H2O,酸溶性铜化合物为CuO,温度较高时,CuSO4?5H2O可分解生成CuO,则在600℃以上时水溶性铜化合物含量减少,故D正确.
故选B.
B、根据表中数据,产物中酸溶性Cu%量居多,所以产物中铜元素主要以CuSO4形式存在,故B错误;
C、根据表中数据可以看出:随温度升高,铁的氧化物在酸中的溶解度降低,故C正确;
D、水溶性铜化合物为CuSO4?5H2O,酸溶性铜化合物为CuO,温度较高时,CuSO4?5H2O可分解生成CuO,则在600℃以上时水溶性铜化合物含量减少,故D正确.
故选B.
点评:本题考查考查较为综合,涉及物质和性质实验设计等问题,侧重于考查学生综合运用化学知识的能力,为一道高中奥赛题,难度大.

练习册系列答案
 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案
相关题目
下列实验操作正确的是( )
| A、用25mL碱式滴定管量取18.0mL KMnO4溶液 |
| B、在含有FeC12杂质的FeC13溶液中通入足量C12后,充分加热,即可得到纯净的FeC13溶液 |
| C、使用湿润的pH试纸测定气体的酸碱性 |
| D、为减小中和滴定误差,锥形必须用待测液润洗后才能使用 |
X、Y、Z是中学化学常见的三种有色物质(其组成的元素均属短周期元素),摩尔质量依次增大,它们均能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂,下列说法错误的是( )
| A、X或Y均能使湿润的淀粉碘化钾试纸变蓝 |
| B、1molY或Z与足量水完全反应时,均转移1mol电子 |
| C、Z为离子化合物,但含有共价键,阴、阳离子个数比为1:2 |
| D、X和Y均能用向上排空气法和排水法收集 |
CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示.下列说法正确的是( )
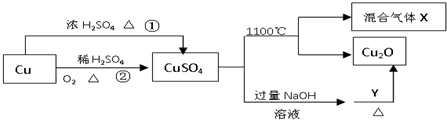

| A、相对于途径①,途径②更好地体现了绿色化学思想 |
| B、Y可以是蔗糖溶液 |
| C、CuSO4在1100℃分解所得气体X可能是SO2和SO3的混合气体 |
| D、将CuSO4溶液蒸发、利用余热蒸干,可制得胆矾晶体 |
下列有关叙述不正确的是( )
| A、若根据反应“H2+Cl2=2HCl”设计成燃料电池,既可发电同时还可用于制备盐酸 |
| B、氯气溶于水达到平衡后,若其他条件不变,加入少量水,水的电离平衡向正向移动 |
| C、25℃时,任何稀溶液中由水电离出的c(H+)和c(OH-)的乘积都为1×10-14 mol2?L-2 |
| D、冰醋酸中逐滴加水,则溶液的导电性先增大后减小 |
 图中X、Y分别是直流电源的两极,通电后,发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的是( )
图中X、Y分别是直流电源的两极,通电后,发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的是( )