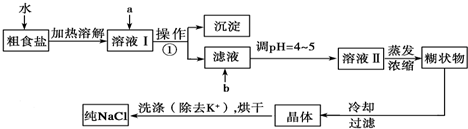
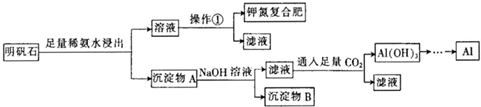
题目内容
回答下列问题
(1)书写草酸(H2C2O4)使酸性KMnO4溶液褪色的离子方程式. .
(2)请用平衡移动原理解释Al(OH)3既能溶解于强酸又能溶解于强碱的原因. .
(1)书写草酸(H2C2O4)使酸性KMnO4溶液褪色的离子方程式.
(2)请用平衡移动原理解释Al(OH)3既能溶解于强酸又能溶解于强碱的原因.
考点:离子方程式的书写,化学平衡移动原理
专题:离子反应专题,化学平衡专题
分析:(1)草酸与酸性的高锰酸钾发生氧化还原反应,生成二氧化碳、锰离子和水;
(2)氢氧化铝为两性氢氧化物,电离方程式:AlO2-+H2O+H+?Al(OH)3?Al3++3OH-;依据平衡移动理论解释加入酸和碱对氢氧化铝电离的影响.
(2)氢氧化铝为两性氢氧化物,电离方程式:AlO2-+H2O+H+?Al(OH)3?Al3++3OH-;依据平衡移动理论解释加入酸和碱对氢氧化铝电离的影响.
解答:
解:(1)草酸与酸性的高锰酸钾发生氧化还原反应,生成二氧化碳、锰离子和水,离子方程式为:2MnO4-+5H2C2O4+6H+═10CO2↑+2Mn2++8H2O;
故答案为:2MnO4-+5H2C2O4+6H+═10CO2↑+2Mn2++8H2O;
(2)氢氧化铝是两性氢氧化物,在水溶液中存在酸式和碱式电离,其电离方程式为AlO2-+H2O+H+?Al(OH)3?Al3++3OH-,向溶液中加入酸,氢离子浓度增大,电离平衡向碱式电离方向移动,氢氧化铝转化为铝离子,向溶液中加入NaOH溶液,溶液中氢氧根离子浓度增大,平衡向酸式电离方向移动,氢氧化铝转化为铝盐,
故答案为:氢氧化铝是两性氢氧化物,在水溶液中存在酸式和碱式电离,其电离方程式为AlO2-+H2O+H+?Al(OH)3?Al3++3OH-,向溶液中加入酸,氢离子浓度增大,电离平衡向碱式电离方向移动,氢氧化铝转化为铝离子,向溶液中加入NaOH溶液,溶液中氢氧根离子浓度增大,平衡向酸式电离方向移动,氢氧化铝转化为铝盐.
故答案为:2MnO4-+5H2C2O4+6H+═10CO2↑+2Mn2++8H2O;
(2)氢氧化铝是两性氢氧化物,在水溶液中存在酸式和碱式电离,其电离方程式为AlO2-+H2O+H+?Al(OH)3?Al3++3OH-,向溶液中加入酸,氢离子浓度增大,电离平衡向碱式电离方向移动,氢氧化铝转化为铝离子,向溶液中加入NaOH溶液,溶液中氢氧根离子浓度增大,平衡向酸式电离方向移动,氢氧化铝转化为铝盐,
故答案为:氢氧化铝是两性氢氧化物,在水溶液中存在酸式和碱式电离,其电离方程式为AlO2-+H2O+H+?Al(OH)3?Al3++3OH-,向溶液中加入酸,氢离子浓度增大,电离平衡向碱式电离方向移动,氢氧化铝转化为铝离子,向溶液中加入NaOH溶液,溶液中氢氧根离子浓度增大,平衡向酸式电离方向移动,氢氧化铝转化为铝盐.
点评:本题考查了离子方程式书写、电解质电离平衡移动的影响因素,熟悉氢氧化铝为两性物质,明确其电离方式是解题关键,题目难度中等.

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
下列实验操作正确的是( )
| A、用25mL碱式滴定管量取18.0mL KMnO4溶液 |
| B、在含有FeC12杂质的FeC13溶液中通入足量C12后,充分加热,即可得到纯净的FeC13溶液 |
| C、使用湿润的pH试纸测定气体的酸碱性 |
| D、为减小中和滴定误差,锥形必须用待测液润洗后才能使用 |
 图中X、Y分别是直流电源的两极,通电后,发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的是( )
图中X、Y分别是直流电源的两极,通电后,发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的是( )| a极板 | b极板 | X电极 | Z溶液 | |
| A | 银 | 铁 | 正极 | AgNO3 |
| B | 石墨 | 石墨 | 负极 | NaOH |
| C | 锌 | 石墨 | 负极 | CuSO4 |
| D | 铜 | 石墨 | 负极 | CuCl2 |
| A、A |
| B、B |
| C、C |
| D、D |
在某一溶液中可能含有下列几种离子:K+、Fe3+、Ag+、Ba2+、NO2-、AlO2-、CO32-、SO32-、SO42-.某该溶液进行有关实验,实验步骤及结果如下:
①向溶液中加入过量稀盐酸,得到气体甲和溶液甲;
②向溶液甲中加入过量NH4HCO3溶液,得到白色沉淀乙、气体乙和溶液乙;
③向溶液乙中加入过量Ba(OH)2溶液并加热,得到白色沉淀丙、气体丙和溶液丙.
④检验气体甲、气体乙、气体丙,都只含有一种成分,而且各不相同.
下列说法正确的是( )
①向溶液中加入过量稀盐酸,得到气体甲和溶液甲;
②向溶液甲中加入过量NH4HCO3溶液,得到白色沉淀乙、气体乙和溶液乙;
③向溶液乙中加入过量Ba(OH)2溶液并加热,得到白色沉淀丙、气体丙和溶液丙.
④检验气体甲、气体乙、气体丙,都只含有一种成分,而且各不相同.
下列说法正确的是( )
| A、气体甲可能为CO2 或者SO2 |
| B、沉淀丙中一定含有BaCO3,可能含有BaSO4 |
| C、该溶液中肯定存在的离子有K+、AlO2-、SO32-、SO42-、NO2- |
| D、只根据实验①能得出溶液中一定没有Fe3+、Ag+、Ba2+,K+是否存在无法确定 |