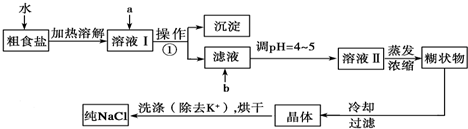
题目内容
一定温度下,在密闭容器中,发生反应:2NO2?2NO+O2,经2min时间后,测得混合气中NO2浓度为0.06mol?L-1,O2的浓度为0.12mol?L-1,且各物质的浓度不再发生变化,求:
(1)NO2的起始浓度?
(2)此时NO2的转化率?
(3)生成NO的反应速率为多少.
(1)NO2的起始浓度?
(2)此时NO2的转化率?
(3)生成NO的反应速率为多少.
考点:化学平衡的计算
专题:化学平衡专题
分析:一定温度下,在密闭容器中,发生反应:2NO2?2NO+O2,经2min时间后,测得混合气中NO2浓度为0.06mol?L-1,O2的浓度为0.12mol?L-1,且各物质的浓度不再发生变化,说明反应达到平衡状态,依据化学平衡三段式列式计算,设二氧化氮起始量为x;
2NO2?2NO+O2
起始量(mol/L) x 0 0
变化量(mol/L) 0.24 0.24 0.12
平衡量(mol/L)x-0.24 0.24 0.12
x-0.24=0.06
x=0.30mol/L
(1)浓度c=
计算得到;
(2)二氧化氮转化率=
×100%;
(3)反应速率v=
计算得到;
2NO2?2NO+O2
起始量(mol/L) x 0 0
变化量(mol/L) 0.24 0.24 0.12
平衡量(mol/L)x-0.24 0.24 0.12
x-0.24=0.06
x=0.30mol/L
(1)浓度c=
| n |
| V |
(2)二氧化氮转化率=
| 消耗量 |
| 起始量 |
(3)反应速率v=
| △c |
| △t |
解答:
一定温度下,在密闭容器中,发生反应:2NO2?2NO+O2,经2min时间后,测得混合气中NO2浓度为0.06mol?L-1,O2的浓度为0.12mol?L-1,且各物质的浓度不再发生变化,说明反应达到平衡状态,依据化学平衡三段式列式计算,设二氧化氮起始量为x;
2NO2?2NO+O2
起始量(mol/L) x 0 0
变化量(mol/L) 0.24 0.24 0.12
平衡量(mol/L)x-0.24 0.24 0.12
x-0.24=0.06
x=0.30mol/L
(1)NO2的起始浓度=0.3 mol/L;
答:NO2的起始浓度0.3 mol/L;
(2)二氧化氮转化率=
×100%=
×100%=80%;
答:此时NO2的转化率80%;
(3)生成NO的反应速率v=
=
=0.12mol/L?min;
答:生成NO的反应速率为0.12mol/(L?min);
2NO2?2NO+O2
起始量(mol/L) x 0 0
变化量(mol/L) 0.24 0.24 0.12
平衡量(mol/L)x-0.24 0.24 0.12
x-0.24=0.06
x=0.30mol/L
(1)NO2的起始浓度=0.3 mol/L;
答:NO2的起始浓度0.3 mol/L;
(2)二氧化氮转化率=
| 消耗量 |
| 起始量 |
| 0.24mol/L |
| 0.3mol/L |
答:此时NO2的转化率80%;
(3)生成NO的反应速率v=
| △c |
| △t |
| 0.24mol/L |
| 2min |
答:生成NO的反应速率为0.12mol/(L?min);
点评:本题考查了和平衡的计算应用,主要是转化率、反应速率概念的计算应用,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
X、Y、Z是中学化学常见的三种有色物质(其组成的元素均属短周期元素),摩尔质量依次增大,它们均能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂,下列说法错误的是( )
| A、X或Y均能使湿润的淀粉碘化钾试纸变蓝 |
| B、1molY或Z与足量水完全反应时,均转移1mol电子 |
| C、Z为离子化合物,但含有共价键,阴、阳离子个数比为1:2 |
| D、X和Y均能用向上排空气法和排水法收集 |
Zn+NO3-+OH-+H2O→NH3+Zn(OH)42-配平后,离子方程式中H2O的系数是( )
| A、2 | B、4 | C、6 | D、8 |
有机物的天然提取和人工合成往往得到的是混合物,假设给你一种这样的有机混合物让你研究,一般要采取的几个步骤是( )
| A、分离、提纯----确定分子式-----确定实验式----确定结构式 |
| B、分离、提纯----确定实验式-----确定分子式-----确定结构式 |
| C、分离、提纯----确定结构式-----确定实验式-----确定分子式 |
| D、确定分子式-----确定实验式----确定结构式-----分离、提纯 |
菜谱中记载:河虾不宜与西红柿同食.主要原因是河虾中含有五价砷,西红柿中含有比较多的维生素C,两者同食时会生成有毒的三价砷.下列说法不正确的是( )
| A、“两者同食”发生的反应中维生素C作还原剂 |
| B、五价砷在维生素C作用下发生了还原反应 |
| C、河虾中含有的五价砷,没有毒性 |
| D、可以推测砒霜中所含的砷元素化合价为+5 |