题目内容
10.活动小组同学采用如图装置制备并测定所得固体中亚硝酸钠(NaNO2)的质量分数(装置可重复使用,部分夹持仪器已省略).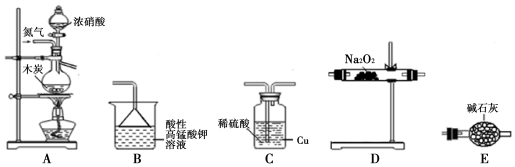
已知:①2NO+Na2O2═2NaNO2;
②酸性条件下,NO、NO2都能与MnO4-反应生成NO3-和Mn2+;NaNO2能使
酸性高锰酸钾溶液褪色.
(1)实验装置的连接顺序为ACEDEB;
(2)C瓶内发生反应的离子方程式为Cu+2H++NO2=Cu2++NO+H2O.
(3)为了测定亚硝酸钠的含量,称取4.0g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.10mol•L-1的酸性KMnO4溶液进行滴定,实验所得数据如表.
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶用蒸馏水洗净后未干燥
c.观察滴定终点时仰视读数
②根据表中数据进行计算,所制得的固体中亚硝酸钠的质量分数为86.25%.
(4)设计实验,比较0.1mol•L-1NaNO2溶液中NO2-的水解程度和0.1mol•L-1HNO2溶液中HNO2电离程度的相对大小25℃时,将两种溶液等体积混合,若混合溶液的pH<7,则说明HNO2的电离程度大于NO2-的水解程度;若pH>7,则说明HNO2的电离程度小于NO2-的水解程度(简要说明实验步骤、现象和结论,仪器和药品自选).
分析 (1)装置A烧瓶中,碳和浓硝酸反应生成二氧化碳、二氧化氮和水,装置C中二氧化氮通入和水反应生成硝酸,硝酸具有强氧化性能氧化铜生成硝酸铜溶液同时生成一氧化氮气体,装置E以吸收杂质CO2、NO2,在装置D中由NO和过氧化钠发生反应制备NaNO2,装置B吸收尾气,为防止水蒸气进入装置D,D与B之间加入装置E;
(2)装置C中二氧化氮通入和水反应生成硝酸,硝酸具有强氧化性能氧化铜生成硝酸铜溶液同时生成一氧化氮气体,据此书写;
(3)①第一组实验数据消耗的酸性高锰酸钾溶液体积偏大,
a.酸式滴定管用蒸馏水洗净后未用标准液润洗,导致标准液被稀释,标准液浓度减小;
b.达到过程中锥形瓶不需要干燥,不影响待测液中溶质的物质的量;
c.滴定终点仰视读数,读出的是凹液面下方读数,读数比实际消耗的标准液体积偏大;
②第一组数据舍弃,计算出其它3组消耗标准液的平均体积,再结合反应方程式计算出样品中亚硝酸钠的质量及质量分数;
(4)在相同温度下把等浓度的亚硝酸钠和亚硝酸等体积混合,测定溶液PH,若PH大于7说明水解程度大,若PH小于7说明电离程度大.
解答 解:(1)装置A烧瓶中,碳和浓硝酸反应生成二氧化碳、二氧化氮和水:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,装置C中二氧化氮通入和水反应生成硝酸,硝酸具有强氧化性能氧化铜生成硝酸铜溶液同时生成一氧化氮气体,装置E以吸收杂质CO2、NO2,在装置D中由NO和过氧化钠发生反应制备NaNO2,装置B吸收尾气,为防止水蒸气进入装置D,D与B之间加入装置E;
故答案为:A C E D E B;
(2)装置C中二氧化氮通入和水反应生成硝酸,硝酸具有强氧化性能氧化铜生成硝酸铜溶液同时生成一氧化氮气体,离子方程式为:Cu+2H++NO2=Cu2++NO+H2O;
故答案为:Cu+2H++NO2=Cu2++NO+H2O;
(3)①第一组实验数据消耗的酸性高锰酸钾溶液体积偏大,会导致测量结果偏高,
a.酸式滴定管用蒸馏水洗净后未用标准液润洗,导致标准液被稀释,滴定过程中消耗的标准液体积会偏大,故正确;
b.锥形瓶不需要干燥,所以锥形瓶洗净后未干燥,不影响测定结果,故错误;
c.滴定终点仰视读数,导致读数偏大,计算出的标准液体积偏大,故正确;
故答案为:ac;
②由于第一组数据偏高,应该舍弃;其它三组消耗标准液平均体积为:(20.02+20.00+19.98)÷3mL=20.00mL,
25mL样品消耗高锰酸钾的物质的量为:0.1000mol/L×0.02L=0.002mol,则250mL样品溶液会消耗高锰酸钾的物质的量为:0.002mol×$\frac{250mL}{25mL}$=0.02mol,根据化合价变化可得反应关系式:2MnO4-~5NO2-,则4.000g样品中含有亚硝酸钠的物质的量为:0.02mol×$\frac{5}{2}$=0.05mol,质量为69g/mol×0.05mol=3.45g,所以反应后的固体中亚硝酸钠的质量分数为:$\frac{3.45g}{4.0g}$×100%=86.25%;
故答案为:86.25%;
(4)依据HNO2溶液中存在电离平衡,NO2-存在水解平衡,比较等浓度的NaNO2溶液中NO2-的水解程度和HNO2溶液中HNO2的电离程度相对大小,实验设计为:25°C将0.1mol/LHNO2和0.1mol/LNaNO2溶液等体积混合,若测定溶液PH<7,说明HNO2的电离程度大于NO2-离子的水解程度,若测定溶液PH>7,说明NO2-离子水解程度大于HNO2的电离程度;
故答案为:25℃时,将两种溶液等体积混合,若混合溶液的pH<7,则说明HNO2的电离程度大于NO2-的水解程度;若pH>7,则说明HNO2的电离程度小于NO2-的水解程度.
点评 本题考查实验方案的设计和探究,考查学生分析和解决问题的能力,涉及化学方程式的书写、物质含量的计算以及电解原理,综合性强,题目难度中等.

 备战中考寒假系列答案
备战中考寒假系列答案| A. | 制玻璃 | B. | 铁矿石与焦碳炼铁 | ||
| C. | 制粗硅 | D. | 制水泥 |
| A. | H2O | B. | CO2 | C. | N2O | D. | CH4 |
| A. | 加入少量NaOH溶液 | B. | 加入少量的NaHSO4溶液 | ||
| C. | 加入少量的CH3COONa溶液 | D. | 加入少量的CuSO4溶液 |
| A. | 已知二元酸H2A在溶液中的电离方程式为:H2A═H++HA- HA-?H++A2-,则NaHA溶液中离子浓度的关系有:c(Na+)═c(A2-)+c(HA-)+c(H2A)和c(A2-)═c(H+)-c(OH-) | |
| B. | 已知:室温时Ka(HA)=10-5.则室温时 0.1mol/LNaA溶液的pH约为10 | |
| C. | HCN溶液加水稀释的过程中$\frac{c({H}^{+})}{c(C{N}^{-})}$减小 | |
| D. | 向明矾溶液中逐滴滴入Ba(OH)2溶液至硫酸根离子刚好完全沉淀时,所得溶液中离子浓度关系有:c(K+)>c(AlO2-)>c(OH-)>c(H+) |

