题目内容
1.下列工业生产中产生的气体产物主要不是二氧化碳的是( )| A. | 制玻璃 | B. | 铁矿石与焦碳炼铁 | ||
| C. | 制粗硅 | D. | 制水泥 |
分析 A.工业制玻璃主要原料有石英、纯碱和石灰石,碳酸钠与二氧化硅在高温条件下反应生成硅酸钠和二氧化碳,碳酸钙与二氧化硅在高温条件下反应生成硅酸钙和二氧化碳;
B.在炼铁高炉中一氧化碳能与氧化铁反应生成铁和二氧化碳;
C.C还原二氧化硅制备粗硅;
D.制造水泥的原料是:石灰石和黏土.
解答 解:A.工业制玻璃主要原料有石英、纯碱和石灰石,制玻璃主要反应为:Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑;CaCO3+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑,气体产物主要是二氧化碳,故A不选;
B.铁矿石与焦碳炼铁,碳与足量氧气反应生成二氧化碳,二氧化碳和碳在高温下反应生成一氧化碳,反应为C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2,CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO,一氧化碳能与氧化铁反应生成铁和二氧化碳,反应的方程式为Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,气体产物主要是二氧化碳,故B不选;
C.用SiO2制备硅单质的反应为SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,产生的气体产物主要不是二氧化碳,故C选;
D.生产水泥以黏土和石灰石为主要原料,经研磨、混合后在水泥回转窑中煅烧,再加入适量石膏,并研成细粉就得到普通水泥,气体产物主要是二氧化碳,故D不选;
故选C.
点评 本题考查了制玻璃、炼铁、制粗硅、制水泥几种工业生产,掌握工业生产原理是解答关键,侧重分析与应用能力的考查,题目难度不大.

 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案I.MnO2的制备:
该学习小组设计了将粗MnO2(含有较多的MnO、MnCO3和Fe2O3)样品转化为纯MnO2实验,其工艺流程如图:
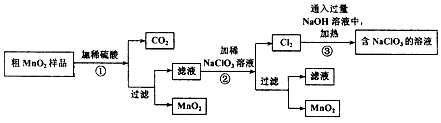
请回答下列问题:
(1)第①步操作中,生成CO2的化学方程式为MnCO3+H2SO4=MnSO4+H2O+CO2↑.
(2)第②步操作中,NaClO3氧化MnSO4的离子方程式为2ClO3-+5Mn2++4H2O=5MnO2+Cl2↑+8H+.
(3)第③步操作中,最终得到的固体除NaClO3外,还一定含有下列物质中的ad(填序号).
a.NaCl b.NaClO c.NaClO4 d.NaOH
(4)为得到纯净的MnO2,须将过滤后的MnO2合并后进行洗涤.洗涤沉淀所用的玻璃仪器有:烧杯、漏斗、玻璃棒,判断是否洗涤干净可选用的试剂是BaCl2(填化学式).
(5)NaClO3和MnO2在一定条件下都可以氧化浓盐酸制取氯气,制取等量的氯气消耗NaClO3与MnO2的物质的量之比为1:3.
(6)工业上可以以石墨为电极电解酸化的硫酸锰制取二氧化锰,该过程的阳极反应式为Mn2+-2e-+2H2O=MnO2+4H+.
II.KMnO4的制备和性质:
(7)实验室由二氧化锰制备高锰酸钾可分二步进行:
第一步:MnO2与KOH共熔并通入氧气:2MnO2+4KOH+O2=2K2MnO4+2H2O
第二步:通入CO2,可使K2MnO4发生歧化反应生成KMnO4和MnO2.
第二步完成反应时,转化为KMnO4的K2MnO4占其全部的百分率约为66.7%(精确到0.1%)
(8)该小组同学为了探究KMnO4溶液和Na2C2O4溶液的反应过程,将酸性KMnO4溶液逐滴滴入一定体积的Na2C2O4溶液中(温度相同,并不断振荡),记录的现象如表:
| 起始加入量(mol) | 平衡时 | ||||
| A | B | C | A或C转化率(%) | C的物质的量分数(%) | 放出或吸收热量(KJ) |
| 1 | 1 | 0 | α1 | φ1 | Q1 |
| 0 | 0 | 2 | α2 | φ2 | Q2 |
| 2 | 2 | 0 | α2 | φ3 | Q3 |
①请将MnO4-氧化C2O42-的离子方程式补充完整:
2MnO4-+C2O42-+16H+=2Mn2++10CO2↑+8H2O
②请分析KMnO4溶液褪色时间变化的可能原因反应生成的Mn2+对反应有催化作用,且c(Mn2+)浓度大催化效果更好.
| A. | 0.225mol/L | B. | 0.25mol/L | C. | 0.45mol/L | D. | 0.55mol/L |
| A. | C12与水反应:C12+H2O═2H++Cl-+ClO- | |
| B. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | Fe跟HCl溶液反应:Fe+2H+═Fe2++H2↑ | |
| D. | BaCO3与盐酸反应:CO32-+2 H+═H2O+CO2↑ |
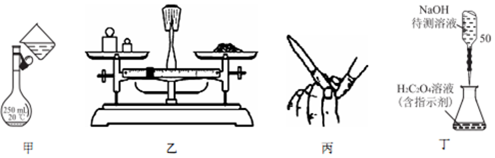
| A. | 用图甲所示操作转移NaOH 溶液到容量瓶中 | |
| B. | 用图乙所示装置准确称得0.1575gH2C2O4•2H2O固体 | |
| C. | 用图丙所示操作检查碱式滴定管是否漏液 | |
| D. | 用图丁所示装置以NaOH 待测液滴定H2C2O4溶液 |
| A. | 131I的质量数为131 | B. | 1mol 131I的质量为131 | ||
| C. | 131I原子核外有5个电子层 | D. | 131I核外最外层电子数为7e- |
| A. | 硫酸铜溶液 | B. | NaOH溶液 | C. | 硝酸 | D. | 水玻璃 |
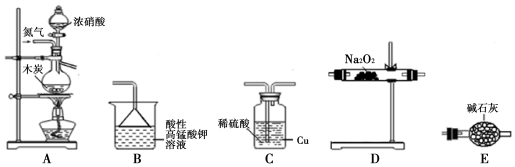
已知:①2NO+Na2O2═2NaNO2;
②酸性条件下,NO、NO2都能与MnO4-反应生成NO3-和Mn2+;NaNO2能使
酸性高锰酸钾溶液褪色.
(1)实验装置的连接顺序为ACEDEB;
(2)C瓶内发生反应的离子方程式为Cu+2H++NO2=Cu2++NO+H2O.
(3)为了测定亚硝酸钠的含量,称取4.0g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.10mol•L-1的酸性KMnO4溶液进行滴定,实验所得数据如表.
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶用蒸馏水洗净后未干燥
c.观察滴定终点时仰视读数
②根据表中数据进行计算,所制得的固体中亚硝酸钠的质量分数为86.25%.
(4)设计实验,比较0.1mol•L-1NaNO2溶液中NO2-的水解程度和0.1mol•L-1HNO2溶液中HNO2电离程度的相对大小25℃时,将两种溶液等体积混合,若混合溶液的pH<7,则说明HNO2的电离程度大于NO2-的水解程度;若pH>7,则说明HNO2的电离程度小于NO2-的水解程度(简要说明实验步骤、现象和结论,仪器和药品自选).
| 实验操作 | 实验目的或结论 | |
| A | 蘸有浓硝酸的玻璃棒靠近浓氨水时冒白烟 | NH3具有还原性 |
| B | 将一块Na放入乙醇溶液中,有气泡产生 | Na能置换乙醇中的氢 |
| C | 可将58.5gNaCl加入盛有500mL水的烧杯中,搅拌、溶解 | 粗略配置浓度为2mol•L-1的NaCl溶液 |
| D | 向氯仿中加入NaOH溶液,加热充分反应后,再加入AgNO3 | 验证氯仿中含有的氯元素 |
| A. | A | B. | B | C. | C | D. | D |