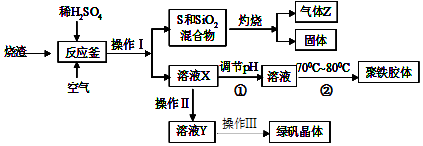
题目内容
5.定量的稀硫酸与过量锌粉反应,为了减慢反应速率但又不影响生成氢气总量的措施是( )| A. | 加入少量NaOH溶液 | B. | 加入少量的NaHSO4溶液 | ||
| C. | 加入少量的CH3COONa溶液 | D. | 加入少量的CuSO4溶液 |
分析 根据反应的实质为Zn+2H+═Zn2++H2↑,为了减缓反应速率,但又不影响生成氢气的总量,则减小氢离子的浓度但不能改变氢离子的物质的量即可,注意Zn过量,以此来解答.
解答 解:A.加入少量NaOH溶液,氢离子浓度减小,所以影响生成氢气总量,故A错误;
B.加入少量NaHSO4固体,溶液氢离子浓度增大,反应速率增大,故B错误;
C.加入CH3COONa溶液,溶液被稀释,且醋酸根与溶液中氢离子结合为醋酸分子,溶液中氢离子降低,且提供的氢离子总量不变,故能减慢反应速率且又不影响氢气生成量,故C正确;
D.Zn可以置换出Cu,构成原电池,加快反应速率,故D错误;
故选C.
点评 本题考查化学反应速率影响因素,为高频考点,比较基础,需注意生成氢气的量不变,注意A选项构成原电池,加快反应速率.

练习册系列答案
相关题目
15.下列有关铝的叙述错误的是( )
| A. | 铝制的容器可以贮存浓硫酸或浓硝酸 | |
| B. | 铝容易形成致密的氧化膜,抗腐蚀性能好 | |
| C. | 工业上电解氯化铝溶液可分解得到铝和氯气 | |
| D. | 工业上常用铝热反应进行焊接铁轨 |
16.NaOH标准溶液的配制和标定,需经过NaOH溶液配制,基准物质H2C2O4•2H2O的称量以及用NaOH溶液滴定等操作.下列有关说法正确的是( )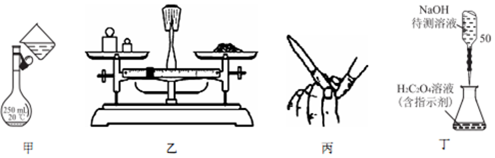

| A. | 用图甲所示操作转移NaOH 溶液到容量瓶中 | |
| B. | 用图乙所示装置准确称得0.1575gH2C2O4•2H2O固体 | |
| C. | 用图丙所示操作检查碱式滴定管是否漏液 | |
| D. | 用图丁所示装置以NaOH 待测液滴定H2C2O4溶液 |
13.下列试剂不能贮存在无色透明玻璃试剂瓶里的是( )
| A. | 硫酸铜溶液 | B. | NaOH溶液 | C. | 硝酸 | D. | 水玻璃 |
10.活动小组同学采用如图装置制备并测定所得固体中亚硝酸钠(NaNO2)的质量分数(装置可重复使用,部分夹持仪器已省略).

已知:①2NO+Na2O2═2NaNO2;
②酸性条件下,NO、NO2都能与MnO4-反应生成NO3-和Mn2+;NaNO2能使
酸性高锰酸钾溶液褪色.
(1)实验装置的连接顺序为ACEDEB;
(2)C瓶内发生反应的离子方程式为Cu+2H++NO2=Cu2++NO+H2O.
(3)为了测定亚硝酸钠的含量,称取4.0g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.10mol•L-1的酸性KMnO4溶液进行滴定,实验所得数据如表.
①第一组实验数据出现较明显异常,造成异常的原因可能是ac(填字母序号).
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶用蒸馏水洗净后未干燥
c.观察滴定终点时仰视读数
②根据表中数据进行计算,所制得的固体中亚硝酸钠的质量分数为86.25%.
(4)设计实验,比较0.1mol•L-1NaNO2溶液中NO2-的水解程度和0.1mol•L-1HNO2溶液中HNO2电离程度的相对大小25℃时,将两种溶液等体积混合,若混合溶液的pH<7,则说明HNO2的电离程度大于NO2-的水解程度;若pH>7,则说明HNO2的电离程度小于NO2-的水解程度(简要说明实验步骤、现象和结论,仪器和药品自选).

已知:①2NO+Na2O2═2NaNO2;
②酸性条件下,NO、NO2都能与MnO4-反应生成NO3-和Mn2+;NaNO2能使
酸性高锰酸钾溶液褪色.
(1)实验装置的连接顺序为ACEDEB;
(2)C瓶内发生反应的离子方程式为Cu+2H++NO2=Cu2++NO+H2O.
(3)为了测定亚硝酸钠的含量,称取4.0g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.10mol•L-1的酸性KMnO4溶液进行滴定,实验所得数据如表.
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶用蒸馏水洗净后未干燥
c.观察滴定终点时仰视读数
②根据表中数据进行计算,所制得的固体中亚硝酸钠的质量分数为86.25%.
(4)设计实验,比较0.1mol•L-1NaNO2溶液中NO2-的水解程度和0.1mol•L-1HNO2溶液中HNO2电离程度的相对大小25℃时,将两种溶液等体积混合,若混合溶液的pH<7,则说明HNO2的电离程度大于NO2-的水解程度;若pH>7,则说明HNO2的电离程度小于NO2-的水解程度(简要说明实验步骤、现象和结论,仪器和药品自选).
14.下列各组物质的性质比较中,正确的是( )
| A. | 稳定性:HCl>H2S>H2O | B. | 碱性:NaOH>KOH>Mg(OH)2 | ||
| C. | 酸性:HClO4>HBrO4>HIO4 | D. | 还原性:I-<Br-<Cl- |
4.将Υ1L的H2和Υ2L的N2在一定条件下发生反应,达到平衡后,混合气体总体积为Υ3L(气体体积均在相同条件下测定),则生成NH3的体积是( )
| A. | (Υ1+Υ2-Υ3)L | B. | (Υ1+Υ2+Υ3)L | C. | (Υ1+Υ2-2Υ3)L | D. | [Υ3-(Υ1+Υ2)]L |
 (CN)2、(OCN)2、(SCN)2 等被称为拟卤素,可分别由CN-、OCN-、SCN-等氧化得到.
(CN)2、(OCN)2、(SCN)2 等被称为拟卤素,可分别由CN-、OCN-、SCN-等氧化得到.